
【题目】元素周期表与元素周期律在学习、研究中有很重要的作用。下表是5种元素的相关信息,W、X都位于第三周期。
元素 | 信息 |
Q | 地壳中含量最高的元素 |
W | 最高化合价为+7价 |
X | 最高价氧化物对应的水化物在本周期中碱性最强 |
Y | 焰色试验(透过蓝色钴玻璃)火焰呈紫色 |
Z | 原子结构示意图为: |
(1)Q在周期表中的位置是__。
(2)W的最高价氧化物对应的水化物的化学式是___。
(3)X单质与水反应的离子方程式是__。
(4)金属性Y强于X,用原子结构解释原因:__,失电子能力Y大于X,金属性Y强于X。
(5)下列对于Z及其化合物的推断中,正确的是__(填字母)。
A.Z的最低负化合价与W的最低负化合价相同
B.Z的氢化物的稳定性弱于W的氢化物的稳定性
C.Z的单质可与X和W形成的化合物的水溶液发生置换反应
【答案】第二周期、第ⅥA族 HClO4 2Na+2H2O=2Na++2OH-+H2↑ 最外层电子数K与Na相同,电子层数K大于Na,原子半径K大于Na AB
【解析】
Q为地壳中含量最高的元素,则Q为O;W、X都位于第三周期,W最高化合价为+7价,X最高价氧化物对应的水化物在本周期中碱性最强,则W为Cl,X为Na;Y的焰色试验(透过蓝色钴玻璃)火焰呈紫色,则Y为K;Z原子结构示意图为: ,为35号元素,则Z为Br;结合元素性质和元素周期律进行分析解答。
,为35号元素,则Z为Br;结合元素性质和元素周期律进行分析解答。
(1)Q为O在周期表中的位置是第二周期、第ⅥA族,
故答案为:第二周期、第ⅥA族;
(2)W为Cl,最高价为+7价,最高价氧化物对应的水化物的化学式是HClO4,
故答案为:HClO4;
(3)X为Na,其单质与水反应生成氢氧化钠和氢气,离子方程式是2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑
(4)X为Na,Y为K,二者同族,最外层电子数K与Na相同,电子层数K大于Na,原子半径K大于Na,则失电子能力K大于Na,金属性K强于Na,
故答案为:最外层电子数K与Na相同,电子层数K大于Na,原子半径K大于Na;
(5)根据分析推断,Z为Br,
A. W为Cl ,Cl与Br同主族,最低负化合价=最高正价-8=+7-8=-1,故A正确;
B. W为Cl ,非金属性:Cl>Br,非金属性越强,气态氢化物的稳定性越强,则Br的氢化物的稳定性弱于Cl的氢化物的稳定性,故B正确;
C. Z为Br,单质为Br2,X和W形成的化合物的水溶液为NaCl溶液,由于氧化性:Cl2>Br2,则Br2不能从氯化钠溶液中置换出氯气,故C错误;
故答案选AB。


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源: 题型:
【题目】化合物Y是一种免疫抑制剂,可由X制得。
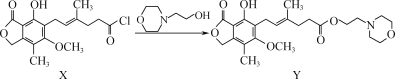
下列有关化合物X、Y的说法正确的是( )
A.X转化为Y的反应为取代反应B.Y的化学式为C23H32O7N
C.1 mol Y最多能与4 mol NaOH反应D.X中所有碳原子可能在同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种双室微生物燃料电池污水净化系统原理如图所示,图中酸性污水中含有的有机物用C6H12O6表示。下列有关该电池的说法不正确的是( )
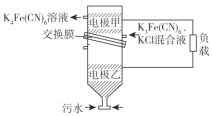
A.正极的电极反应为Fe(CN)63-+ e- =Fe(CN)64-
B.电池的总反应为C6H12O6 + 24Fe(CN)63-+6H2O=6CO2↑+Fe(CN)64-+24H+
C.该“交换膜”可选用“质子交换膜”
D.若将“K4Fe(CN)6溶液”改为“O2”,当有22.4L O2参与反应时,理论上转移4mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图装置制备并收集干燥纯净的Cl2。
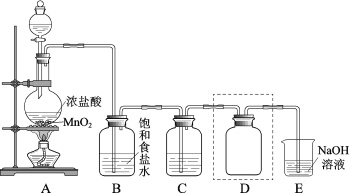
(1)装置A中反应的化学方程式是___。
(2)装置B的作用是__。
(3)装置C中盛放的物质是__。
(4)装置D用于收集Cl2,请将图中装置D的导气管补充完整___。
(5)装置E用于吸收尾气,E中反应的离子方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年2月17日下午,在国务院联防联控机制发布会上,科技部生物中心副主任孙燕荣告诉记者:磷酸氯喹对“COVID-19”的治疗有明确的疗效,该药是上市多年的老药,用于广泛人群治疗的安全性是可控的。其合成路线如图所示:

已知:醛基在一定条件下可以还原成甲基。回答下列问题:
(1)有机物A为糠醛,它广泛存在于各种农副产品中。A中含氧官能团的名称为______,A与新制氢氧化铜悬浊液反应的化学方程式为_______。
(2)C的结构简式为________,D与E之间的关系为_______。
(3)反应⑦的反应类型为_______;反应⑤若温度过高会发生副反应,其有机副产物的结构简式为____。
(4)有机物E有多种同分异构体,其中属于羧酸和酯的有______种,在这些同分异构体中,有一种是羧酸,且含有手性碳原子,其名称为_________。
(5)以2—丙醇和必要的试剂合成2—丙胺[CH3CH(NH2)CH3]:_________(用箭头表示转化关系,箭头上注明试剂)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)N2(g)+3H2(g)2NH3(g) △H<0,研究表明金属催化剂可加速氨气的合成。下表为某温度下等质量的不同金属分别催化合成氨气时,氢气的初始速率(mmol min-1)。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①不同催化剂存在下,合成氨气反应的活化能最大的是_______ (填写催化剂的化学式)。
②某研究小组进一步探究催化剂对合成氨气的影响。将N2和H2以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NH3含量,如下图,从而确定温度对催化剂的影响。a点___ (填“是”或“不是”)对应温度下氨气平衡时的百分含量,说明其理由___。

(2)氨气的分解反应2NH3N2+3H2 △H<0,,在实际生产中往刚性容器中同时通入氨气和水蒸气,测得容器总压和氨气转化率随时间变化结果如图所示。
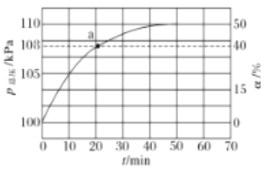
①平衡时,p(H2O)= ___kPa,平衡常数Kp=_____KPa2(Kp为以分压表示的平衡常数)。
②反应速率v=v正-v逆=K正p2(NH3)-K逆p(N2)p3(H2),k正、k逆分别为正、逆反应速率常数。计算a处的![]() =__。
=__。
(3)液氨中,2NH3(l)NH2-+NH4+,用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应______。
(4)在室温下用氨水吸收SO2。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的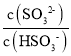 =____。(已知25℃,Kb(NH3H2O)=1.810-5;Ka1(H2SO3)=.310-2,Ka2(H2SO3)=6.210-8)
=____。(已知25℃,Kb(NH3H2O)=1.810-5;Ka1(H2SO3)=.310-2,Ka2(H2SO3)=6.210-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.Ba(OH)2和H2SO4两溶液混合:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.氯气溶于水:H2O+Cl2= 2H++ Cl-+ClO-
C.锌和硝酸银溶液反应:Zn+Ag+=Ag+Zn2+
D.向Al2(SO4)3溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.158 | 158 |
硝酸银 | 0.04 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是__________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸
(2)在溶液配制过程中,下列操作正确且对配制结果没有影响的是__________。
A.将药品放入容量瓶中加蒸馏水溶解
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(3)配制上述500mL“鲜花保鲜剂”所需的玻璃仪器有:烧杯、玻璃棒、_____________、__________。(在横线上填写所缺仪器的名称)
(4)鲜花保鲜剂中K+(蔗糖、阿司匹林中不含K+) 的物质的量浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.用石墨作电极电解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.过量的铁粉溶于稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O
C.用Na2S2O3溶液吸收水中的Cl2:4Cl2+S2O32-+5H2O=10H++2SO42-+8Cl-
D.SO2通入FeCl3溶液中:SO2+Fe3++2H2O=SO42-+Fe2++4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com