
| 化合物 | 燃烧热/kJ•mol-1 | 化合物 | 燃烧热/kJ•mol-1 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 异戊烷 | 3531.3 |
| A. | 正戊烷的燃烧热小于3531.3kJ•mol-1 | |
| B. | 稳定性:正丁烷>异丁烷 | |
| C. | 乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g);△H=-1560.8 kJ | |
| D. | 相同物质的量的烷烃CnH2n+2,n越大,燃烧放出的热量越多 |
分析 A、正丁烷的燃烧热和其同分异构体的燃烧热相近,比含有支链的同分异构体高点,以此来分析正戊烷的燃烧热;
B、物质具有的能量越低越稳定;
C、乙烷的燃烧热为1560.8KJ/mol,说明完全燃烧1mol乙烷生成二氧化碳和液态水时会放出1560.8KJ的热量;
D、相同质量的烷烃,燃烧放热多少和氢的质量分数有关.
解答 解:A、正戊烷和2-甲基丁烷互为同分异构体,由表格中正丁烷、异丁烷的燃烧热比较可知,则互为同分异构体的化合物,支链多的燃烧热小,则正丁烷的燃烧热大于2-甲基丁烷,即正戊烷的燃烧热大约在3540KJ/mol左右,且大于3531.3KJ/mol,故A错误;
B、由表格中的数据可知,异丁烷的燃烧热比正丁烷的燃烧热小,则异丁烷的能量低,即热稳定性为正丁烷<异丁烷,故B错误;
C、根据乙烷燃烧热的含义:完全燃烧1mol乙烷生成二氧化碳和液态水时会放出1560.8KJ的热量,所以热化学方程式为2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l);△H=-3121.6kJ/mol,故C错误;
D、相同物质的量的烷烃,碳的物质的量分数越大,燃烧放热越多,即n越大,燃烧放出的热量越多,故D正确.
故选D.
点评 本题是一道关于化学反应中的能量变化以及燃烧热概念的题目,可以根据所学知识进行回答,难度不大.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
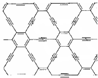 石墨炔是由1,3-二炔键与苯环形成的平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能.下列关于石墨炔的说法不正确的是( )
石墨炔是由1,3-二炔键与苯环形成的平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能.下列关于石墨炔的说法不正确的是( )| A. | 石墨炔属于芳香烃 | |
| B. | 石墨炔与金刚石互为同素异形体 | |
| C. | 石墨炔有望代替半导体材料硅在电子产品中得到广泛应用 | |
| D. | 石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20mL 0.5mol/L AlCl3溶液 | B. | 30mL 1mol/L KCl溶液 | ||
| C. | 7.5mL 2mol/L MgCl2溶液 | D. | 10mL 3mol/L NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
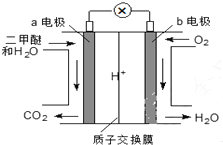 二甲醚(CH3OCH3)是一种绿色、可再生的新能源.右图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔Pt电极).该电池工作时,下列说法不正确的是( )
二甲醚(CH3OCH3)是一种绿色、可再生的新能源.右图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔Pt电极).该电池工作时,下列说法不正确的是( )| A. | a电极为该电池负极 | |
| B. | O2在b电极上反应为O2+2H2O+4e-=4OH- | |
| C. | 电池工作时,若a电极上有1molCH3OCH3放电,电路中有12mol电子转移 | |
| D. | 电池工作时,电池内部H+从a电极移向b电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
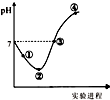 常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )| A. | 曲线起点处水的电离程度最大,可用pH试纸测定溶液pH | |
| B. | ②点之前所发生反应的离子方程式为Cl2+H2O=2H++Cl-+ClO- | |
| C. | 氯气~氯水体系中:c(H+)=c(Cl2)+c(HClO)+c(ClO-) | |
| D. | ③点所示溶液中:c(Na+)=c(Cl-)+c(ClO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | X位于元素周期表中第2周期、第ⅤA族 | |
| B. | Y的一种氢化物不稳定,易分解 | |
| C. | W的非金属性比Y的非金属性弱 | |
| D. | Z的最高价氧化物的水化物可与X的最高价氧化物的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu和Fe相连插入某溶液中形成原电池,则Fe一定作负极 | |
| B. | MgCl2中混有少量的FeCl3,可以通过溶解,加入过量MgO、过滤、结晶等操作进行提纯 | |
| C. | 用惰性电极电解CuSO4溶液一段时间后,若需加入适量的Cu(OH)2才能使溶液恢复到电解前状态,说明阴极只有Cu2+被还原 | |
| D. | 将Fe、Cu的混合物投入FeCl2和CuCl2的混合溶液中,最后可能只有Fe剩余 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com