
 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
分析 (1)煤的气化是利用煤与水蒸气高温条件小反应,生成CO和H2的过程;
(2)利用盖斯定律计算,通过①×2+②+③可得所求反应方程式,则△H=-90.8kJ/mol×2-23.5kJ/mol-41.3kJ/mol=-246.4kJ/mol;
(3)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,应使平衡向正反应方向移动,可减少CO2的浓度或分离出二甲醚,由于反应放热,升高温度平衡向逆反应方向移动,转化率减小,催化剂不影响平衡移动,而增加CO的浓度,CO的转化率反而减小;
(4)根据方程式计算平衡常数,然后利用三段式法解答;
(5)n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;根据甲烷的量计算生成的二氧化碳的量,结合反应方程式判断反应产物及发生的反应,由此分析解答.
解答 解:(1)煤的气化是利用煤与水蒸气高温条件小反应,生成CO和H2的过程:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2,
故答案为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2;
(2)由盖斯定律可知,通过①×2+②+③可得所求反应方程式,3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-90.8kJ/mol×2-23.5kJ/mol-41.3kJ/mol=-246.4kJ/mol,
故答案为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-246.4 kJ•mol-1;
(3)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,应使平衡向正反应方向移动,
ab可减少CO2的浓度或分离出二甲醚,由于反应放热,升高温度平衡向逆反应方向移动,转化率减小,催化剂不影响平衡移动,而增加CO的浓度,CO的转化率反而减小,
a.反应是气体体积减小的放热反应,高温低压,平衡逆向进行,故a错误;
b.低温高压,平衡正向进行,一氧化碳转化率增大,故b正确;
c.减少CO2的浓度,平衡正向进行,一氧化碳转化率增大,故c正确;
d.两种反应物,增大一种会提高另一种的转化率,增加CO的浓度CO的转化率反而减小,故d错误;
e.分离出二甲醚,平衡正向进行,一氧化碳转化率增大,故e正确
f.加入催化剂改变反应速率,不改变化学平衡,一氧化碳转化率不变,故f错误;
故选b、c、e,
故答案为bce;
(4)①该反应的平衡常数表达式为:K=$\frac{c(C{H}_{3}OC{H}_{3})c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$,
将所给浓度带入平衡常数表达式:$\frac{0.6×0.6}{0.4{4}^{2}}$=1.86<400,故反应向正反应方向进行,正反应速率大于逆反应速率,
故答案为:>;
②2CH3OH(g)≒CH3OCH3(g)+H2O(g) 某时刻浓度(mol•L-1):0.44 0.6 0.6
转化浓度(mol•L-1):2x x x
平衡浓度(mol•L-1):0.44-2x 0.6+x 0.6+x
K=$\frac{(0.6+x)^{2}}{(0.44-2x)^{2}}$,解得x=0.2mol/L,
故平衡时c(CH3OH)=0.44mol/L-0.2mol/L×2=0.04mol/L,
故答案为:0.04 mol•L-1;
(5)n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;
①当0<V≤44.8 L时,0<n(CH4)≤2mol,则0<n(CO2)≤2mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O,
故答案为:CH4+2O2+2KOH=K2CO3+3H2O;
②当44.8 L<V≤89.6 L,2mol<n(CH4)≤4mol,则2mol<n(CO2)≤4mol,发生反应①②③,得到K2CO3和KHCO3溶液,则负极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-,故答案为:CH4-8e-+9CO32-+3H2O=10HCO3-;
③当V=67.2 L时,n(CH4)=3mol,n(CO2)=3mol,则电池总反应式为3CH4+6O2+4KOH=K2CO3+2KHCO3+7H2O,则得到1molK2CO3和2molKHCO3的溶液,则c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案为:c(HCO3-)>c(CO32-)>c(OH-).
点评 本题考查较为综合,通过计算书写燃料电池的电极反应式、溶液中离子浓度大小关系等重要考点,题目难度中等,注意“始、转、平”是解决有关化学平衡的“三段论”解题法,当三组量一旦确定,可以解答有关平衡的平衡常数计算、转化率、反应速率、平衡时成分的体积分数等的关键.


科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 0.20 | 20.80 |
| 第三次 | 10.00 | 4.10 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  铁钉易被腐蚀 | |
| B. |  滴加少量KSCN溶液,溶液变为血红色 | |
| C. |  燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 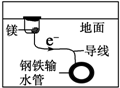 用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| B. | 燃烧一定要有氧气参加 | |
| C. | 吸热反应在常温下也有可能发生 | |
| D. | 氧化还原反应一定是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸钠(固体) | B. | 水 | ||
| C. | 硫酸钾溶液 | D. | 10 mL1mol•L-1 H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com