
| A. | ①② | B. | ①②③ | C. | ②③ | D. | ①②③④ |
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | SO2通入溴水中 | 溴水褪色 | SO2具有漂白性 |
| B | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液变成黄色 | 氧化性:H2O2>Fe2+ |
| C | 将溴乙烷与NaOH的乙醇溶液共热,将生成的气体直接通入KMnO4酸性溶液中 | KMnO4酸性溶液褪色 | 乙烯使KMnO4酸性溶液褪色 |
| D | 向a、b两支盛有KI3溶液的试管中分别加入淀粉溶液、硝酸银溶液. | a试管中溶液变蓝 b试管中产生黄色沉淀 | KI3溶液中存在平衡I3--?I2+I- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水溶解氯化银沉淀:AgCl+2NH3•H2O=[Ag(NH3)2]++Cl-+2H2O | |
| B. | CH3COOH溶液除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 酸性K2Cr2O7溶液氧化双氧水:Cr2O72-+8H++5H2O2=2 Cr3++4O2↑+9H2O | |
| D. | 将NaHSO4与Ba(OH)2溶液混合至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2CO3溶液中加入等浓度等体积的盐酸:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | NaHS溶液中:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | pH相同的①CH3COONa溶液、②NaClO溶液中c(Na+):①<② | |
| D. | pH=9的0.1mol•L-1的NaHR溶液中:c(HR-)>c(H+)>c(R2-)>c(H2R) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
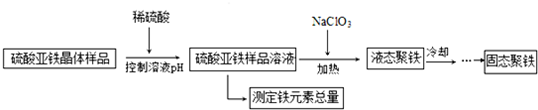
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
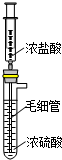 实验室用如图装置制备HCl气体.
实验室用如图装置制备HCl气体.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
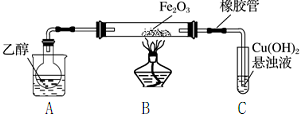
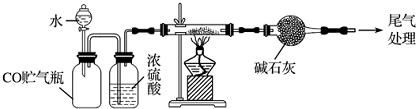
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com