
化合物A、B是中学常见的物质,其阴阳离子可从下表中选择
阳离子 | K+ 、Na+ 、Fe2+ 、Ba2+、NH4+ |
阴离子 | OH-、NO3—、I-、HCO3—、AlO2—、HSO4— |
(1)若A、B的水溶液均为无色,B的水溶液呈碱性,且混合后只产生不溶于稀硝酸的白色沉淀及能使红色石蕊试纸变蓝的气体。
①B的化学式为__________________。
②A、B溶液混合后加热呈中性,反应的离子方程式为__________________________。
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化。则
①A为_______________。
②经分析上述过程中溶液变黄的原因可能有两种:
Ⅰ._______ _____________________。? Ⅱ.___________ ____________。
③请用一简易方法证明上述溶液变黄的原因__________________________________。
④利用溶液变黄原理,将其设计成原电池,若电子由a流向b,则b极的电极反应式为_______________________________________
(1)①Ba(OH)2 ②H++SO42—+NH4++Ba2++2OH-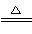 BaSO4↓+NH3↑+2H2O
BaSO4↓+NH3↑+2H2O
(2)①FeI2 ②Ⅰ.仅有I-被氧化成I2使溶液呈黄色
Ⅱ.I-、Fe2+均被氧化使溶液呈黄色
③取少量变黄溶液于试管中,滴加几滴KSCN溶液,若变红则Ⅱ合理(其他合理答案亦可)
④NO3—+4H++3e-=NO↑+2H2O
【解析】(1)根据A、B的性质和反应现象可知,A为NH4HSO4,B为Ba(OH)2,二者1∶1混合反应,加热后溶液显中性,反应的离子方程式为:H++SO42—+NH4++Ba2++2OH-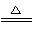 BaSO4↓+NH3↑+2H2O。
BaSO4↓+NH3↑+2H2O。
(2)若A的水溶液呈浅绿色,说明A为亚铁盐;B的水溶液无色且其焰色反应为黄色,B为钠盐。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,说明B为硝酸钠;由A、B的水溶液混合亦无明显变化知,A只能是FeI2。


科目:高中化学 来源: 题型:
 中学化学中常见的物质有如图所示的转化关系(反应条件略去).X、Y、Z、W是单质,其余均为化合物,A、W、Z常温下呈气态,且A是一种大气污染物,B是一种常用的酸.
中学化学中常见的物质有如图所示的转化关系(反应条件略去).X、Y、Z、W是单质,其余均为化合物,A、W、Z常温下呈气态,且A是一种大气污染物,B是一种常用的酸.


查看答案和解析>>
科目:高中化学 来源: 题型:
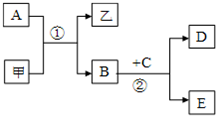 图所示的转化关系中,甲、乙及A、B、C、D、E均为中学常见的化学物质,其中甲、乙为化合物,A、B、D为单质.
图所示的转化关系中,甲、乙及A、B、C、D、E均为中学常见的化学物质,其中甲、乙为化合物,A、B、D为单质.
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、X是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去).请回答下列问题:
A、B、C、X是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、X是中学化学中常见的物质,它们之间的转化关系如下图所示(部分产物已略去).请回答下列问题:
A、B、C、X是中学化学中常见的物质,它们之间的转化关系如下图所示(部分产物已略去).请回答下列问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com