
| X | Y | Z | |
| A. | FeCl2溶液 | FeCl3 | KSCN溶液 |
| B. | Al粉 | Fe粉 | NaOH溶液 |
| C. | Fe2(SO4)3溶液 | FeSO4 | Cl2 |
| D. | FeCl2溶液 | CuCl2 | Fe粉 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯化铁与KSCN溶液结合生成络离子,不能除杂;
B.Al与NaOH溶液反应;
C.亚铁离子与氯气反应;
D.Fe与氯化铜反应生成氯化亚铁和Cu.
解答 解:A.氯化铁与KSCN溶液结合生成络离子,不能除杂,应加铁粉、过滤除杂,故A错误;
B.Al与NaOH溶液反应,将原物质除去,应选磁铁分离,故B错误;
C.亚铁离子与氯气反应,引入新杂质氯离子,应选过氧化氢,故C错误;
D.Fe与氯化铜反应生成氯化亚铁和Cu,则反应后过滤可除杂,故D正确;
故选D.
点评 本题考查混合物分离提纯,侧重于学生的分析能力的考查,为高考常见题型,注意把握物质的性质、性质差异及发生的反应为解答该类题目的关键,注意元素化合物知识的综合应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
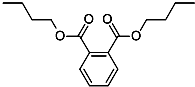 今年白酒行业塑化剂风波成为人们关注的焦点,塑化剂的其中一种邻苯二甲酸二丁酯(DBP)的结构如图所示,可由邻苯二甲酸(
今年白酒行业塑化剂风波成为人们关注的焦点,塑化剂的其中一种邻苯二甲酸二丁酯(DBP)的结构如图所示,可由邻苯二甲酸(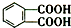 )与正丁醇发生酯化反应制得,下列有关说法不正确的是( )
)与正丁醇发生酯化反应制得,下列有关说法不正确的是( )| A. | 邻苯二甲酸二丁酯(DBP)分子式为:C16H22O4 | |
| B. | 邻苯二甲酸二丁酯(DBP)苯环上的一氯代物有4种 | |
| C. | 邻苯二甲酸二丁酯(DBP)属于乙酸乙酯的同系物 | |
| D. | 丁醇有4种不同结构,所以戊醛也有4种不同结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将钠投入FeSO4溶液中,可以得到单质铁 | |
| B. | 将足量的Na2O2和Na2O分别加入酚酞试液中,最终溶液均为红色 | |
| C. | Na2O与Na2O2中阴阳离子的个数比均为1:2 | |
| D. | 在2Na2O2+2H2O=4NaOH+O2反应中,每生成1molO2,消耗2mol氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
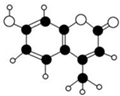 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示.对于该有机物,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示.对于该有机物,下列有关叙述正确的是( )| A. | 该物质不能与浓溴水发生取代反应 | |
| B. | 1mol该物质最多能与5mol H2加成 | |
| C. | 该物质能使酸性KMnO4溶液褪色 | |
| D. | 1mol该物质最多能与含2mol NaOH的溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
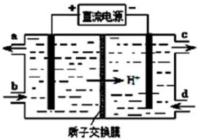
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3═2H++CO32- | B. | NaClO═Na++Cl-+O2- | ||
| C. | NaHCO3═Na++H++CO32- | D. | NaOH═Na++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
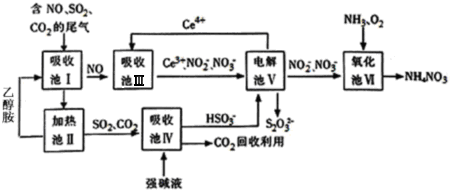
 硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.
硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com