
硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
[甲方案]:如右图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
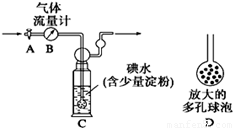
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是___________________________________。
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量_________(填“偏高”、“偏低”或“无影响”)。
[乙方案]:实验步骤如下面流程图所示:
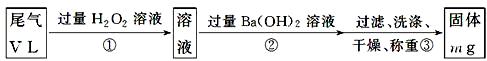
(3)步骤①中过量H2O2的作用是
(4)写出步骤②中反应的化学方程式______________________________________
(5)步骤②中Ba(OH)2是否足量的判断方法是_______________________________
___________________________________________________________________。
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为_____________________________(用含有V、m的代数式表示)。
(1)增大气体与溶液的接触面积,有利于SO2与碘水反应
(2)偏低
(3)使SO2完全转化为SO42-
(4)H2SO4+Ba(OH)2=BaSO4↓+2H2O
(5)静置分层后,往上层溶液中继续滴加Ba(OH)2溶液,若无浑浊现象产生,则Ba(OH)2已足量,反之不足。
(6)22.4m/233V或2240m/233V% (3分)
【解析】
试题分析:甲方案利用的原理为:SO2+I2+2H2O=H2SO4+2HI,最后测定剩余气体的体积,进而定尾气中二氧化硫的含量;
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以增大SO2与碘水的接触面积,使SO2和碘水充分反应;
故答案为:增大SO2与碘水的接触面积,使SO2和碘水充分反应;
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,则通入尾气的体积增大,因此SO2含量偏低;
故答案为:偏低;
乙方案利用的原理为:SO2+H2O2=H2SO4,H2SO4+Ba(OH)2=BaSO4↓+2H2O,最后沉淀硫酸钡的质量计算尾气中二氧化硫的质量,进而计算尾气二氧化硫含量;
(3)由方案原理可知,H2O2是将SO2完全转化为SO42-;
故答案为:将SO2完全转化为SO42-;
(4)步骤②中反应的化学方程式为:H2SO4+Ba(OH)2=BaSO4↓+2H2O;
故答案为:H2SO4+Ba(OH)2=BaSO4↓+2H2O;
(5)步骤②中Ba(OH)2是否足量的判断方法是:静置分层后,向上层清液中继续滴加Ba(OH)2溶液,若无浑浊现象产生说明Ba(OH)2足量,否则不足;
故答案为:静置分层后,向上层清液中继续滴加Ba(OH)2溶液,若无浑浊现象产生说明Ba(OH)2足量,否则不足;
(6)mg是硫酸钡的质量,硫酸钡的物质的量为mg÷233g/mol= (m/233)mol,根据硫元素守恒可知二氧化硫的体积为(m/233)mol×22.4L/mol="(22.4m/233)" L,故尾气中二氧化硫的体积分数(22.4m/233) L/ VL=22.4m/233V,故答案为:22.4m/233V。
考点:探究物质的组成或测量物质的含量
点评:本题考查学生对实验原理与实验操作的理解、实验方案设计、元素化合物性质、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:


 Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O
Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O
Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O Mn3O4+SO2↑+2SO3↑+3H2O
Mn3O4+SO2↑+2SO3↑+3H2O Mn3O4+SO2↑+2SO3↑+3H2O
Mn3O4+SO2↑+2SO3↑+3H2O查看答案和解析>>
科目:高中化学 来源: 题型:
| n(SO32-) |
| n(HSO3-) |
|
91:9 | 1:1 | 9:91 | ||
| 室温下pH | 8.2 | 7.2 | 6.2 |
| n(SO32-) |
| n(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用,其中接触法制硫酸工业中就要用到V2O5作催化剂:
2SO2(g)+O2(g) 2SO3(g) ΔH<0。
某温度下,将2mol SO2和1mol O2置于10 L密闭容器中,在V2O5作催化剂下经5min反应达平衡,SO2的平衡转化率(α)为80%。
(1)5min内 v(SO3 )= mol·L-1·min-1
(2)该温度下平衡常数K=
(3)若缩小容器体积,至达到新的平衡,在图中画出反应速率变化图象。
(4)硫酸工业尾气SO2用浓氨水吸收,反应的离子方程式是 ,吸收后的产物最终可制成肥料硫铵[即(NH4)2SO4]。
(5)某含钒化合物及硫酸的电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。
①用该电池电解(NH4)2SO4溶液生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极电极反应式可表示为 ;若电解得1mol(NH4)2S2O8,则电池左槽中H+将 (填“增大”或“减少”) mol。
②电池使用一段时间后对其进行充电,充电过程中,阳电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源:2012届浙江省衢州二中高三下学期第一次综合练习理科综合试卷(化学部分) 题型:填空题
钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用,其中接触法制硫酸工业中就要用到V2O5作催化剂:
2SO2(g)+O2(g)  2SO3(g) ΔH<0。
2SO3(g) ΔH<0。
某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,在V2O5作催化剂下经5min反应达平衡,SO2的平衡转化率(α)为80%。
(1)5min内 v(SO3 )= mol·L-1·min-1
(2)该温度下平衡常数K=
(3)若缩小容器体积,至达到新的平衡,在图中画出反应速率变化图象。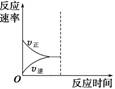
(4)硫酸工业尾气SO2用浓氨水吸收,反应的离子方程式是 ,吸收后的产物最终可制成肥料硫铵[即(NH4)2SO4]。
(5)某含钒化合物及硫酸的电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。
①用该电池电解(NH4)2SO4溶液生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极电极反应式可表示为 ;若电解得1mol(NH4)2S2O8,则电池左槽中H+将 (填“增大”或“减少”) mol。
②电池使用一段时间后对其进行充电,充电过程中,阳电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇区高三上学期期末(一模)考试化学试卷(解析版) 题型:填空题
硫元素的含氧酸盐在工业上用途广泛,完成下列填空。
工业上用Na2SO3溶液处理工业尾气中的SO2,下表数据表示反应过程中 随pH变化的关系:
随pH变化的关系:
|
|
91:9 |
1:1 |
9:91 |
|
室温下pH |
8.2 |
7.2 |
6.2 |
(1)简述 = 1时,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则
= 1时,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则
c (HSO3-) + 2c (SO32-) = _______ mol/L 。
(2)已知:Ki1(H2SO3)> Ki(HAc) > Ki2(H2SO3) > Ki2(H2CO3),要使NaHSO3溶液中c(Na+):c(HSO3-)接近1:1,可在溶液中加入少量____________。
a.H2SO3溶液 b.NaOH溶液 c.冰醋酸 d.Na2CO3
(3)实验室通过低温电解KHSO4溶液制备过二硫酸钾K2S2O8,写出熔融KHSO4的电离方程式:__________________________________________。
(4)S2O82-有强氧化性,还原产物为SO42-,硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。书写此反应的化学方程式: 。
(5)已知:S2O32-有较强的还原性,实验室可用I-测定K2S2O8样品的纯度:反应方程式为:
S2O82-+2I-→2SO42-+I2 ……① I2+2S2O32-→2I-+S4O62- ……②
S2O82-、S4O62-、I2氧化性强弱顺序:__________________________。
(6)K2S2O8是偏氟乙烯(CH2=CF2)聚合的引发剂,偏氟乙烯由CH3—CClF2气体脱去HCl制得,生成0.5 mol偏氟乙烯气体要吸收54 kJ的热,写出反应的热化学方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com