


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��0.050mol SO2��0.030mol O2�����ݻ�Ϊ1L���ܱ������У���һ�������·������·�Ӧ��2SO2��g��+O2��g��?2SO3��g������H=-196.64kJ/mol��
��0.050mol SO2��0.030mol O2�����ݻ�Ϊ1L���ܱ������У���һ�������·������·�Ӧ��2SO2��g��+O2��g��?2SO3��g������H=-196.64kJ/mol���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶�/��C | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| T���棩 | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
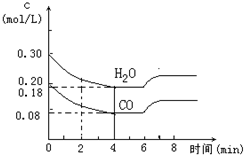
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �����£���0.1mol/L CH3COOH��Һ�ζ�20mL O.1mol/L NaOH��Һ�ĵζ�������ͼ��ʾ�����ڻ�Ϻ����Һ����������Ũ�ȵĹ�ϵʽ�ɲ���ȷ���ǣ�������Һ���ʱ����仯����������
�����£���0.1mol/L CH3COOH��Һ�ζ�20mL O.1mol/L NaOH��Һ�ĵζ�������ͼ��ʾ�����ڻ�Ϻ����Һ����������Ũ�ȵĹ�ϵʽ�ɲ���ȷ���ǣ�������Һ���ʱ����仯����������| A��pH=8ʱ��c��Na+����c��CH3COO-����c��OH-����c��H+�� |
| B��a��ʱ��c��OH-��=c��H+��+c��CH3COO-��+c��CH3COOH�� |
| C��PH=7ʱ��c��CH3COO-��+c��H+��=c��Na+��+c��OH-�� |
| D��b��ʱ��c��CH3COO-��+c��CH3COOH��=0.05mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
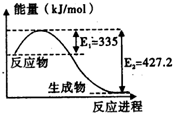 ��1����֪��C��s��+O2��g��=CO2��g����H=-393.5kJ/mol
��1����֪��C��s��+O2��g��=CO2��g����H=-393.5kJ/mol| 1 |
| 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Fe2O3 | CO | Fe | CO2 | |
| ��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| ��/mol | 1.0 | 2.0 | 1.0 | 1.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ������и��⣺
������и��⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1 mol NaHSO4�����к��е���������Ϊ3NA |
| B�������£�0.1mol/L Na2C03��Һ��C032-����Ŀһ��С��0.1NA |
| C����״���£�2.24LCH3Cl�к��еĹ��õ��Ӷ���ΪO.4NA |
| D����ʯī���缫���CuSO4��Һ������������2.24L��״���µ�����ʱ��������Һ�ĵ�����Ϊ0.4NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com