
关于下列各组物质的相互关系,判断正确的是( )

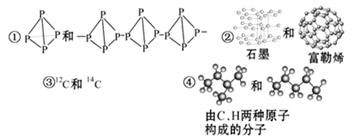
A.互为同素异形体的是①② B.互为同位素的是②③
C.互为同一物质的是①⑤ D.互为同分异构体的是④⑤
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是( )
A.氢气通过灼热的CuO粉末
B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热反应
D.将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
 已知:主反应 2Na2CO3 (aq) + 3H2O2 (aq)
已知:主反应 2Na2CO3 (aq) + 3H2O2 (aq)  2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
副反应 2H2O2 = 2H2O + O2↑
滴定反应 6KMnO4 + 5(2Na2CO3·3H2O2) +19H2SO4 =
3K2SO4 + 6MnSO4 +10Na2SO4 + 10CO2 ↑ + 15O2↑ + 34H2O
 50 °C时 2Na2CO3·3H2O2 (s) 开始分解
50 °C时 2Na2CO3·3H2O2 (s) 开始分解
请回答下列问题:
(1)图中支管的作用是 。
(2)步骤①的关键是控制温度,其措施有 、
和 。
(3)在滤液X中加入适量NaCl固体或无水乙醇,
均可析出过碳酸钠,原因是 。
(4)步骤③中选用无水乙醇洗涤产品的目的
是 。
(5)下列物质中,会引起过碳酸钠分解的有 。
A.Fe2O3 B.CuO
C.Na2SiO3 D.MgSO4
(6)准确称取0.2000 g 过碳酸钠于250 mL 锥形瓶中,加50 mL 蒸馏水溶解,再加50 mL 2.0 mol·L-1 H2SO4,用2.000×10-2 mol·L-1 KMnO4 标准溶液滴定至终点时消耗30.00 mL,则产品中H2O2的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ. A、B、C、D、E、F、G七种元素,试按下列所给条件推断,
①A、B、C是同一周期的金属元素,原子核外有三个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C;
②D、E是非金属元素,它们跟氢气化合可生成气态氢化物HD和HE,室温时,D的单质是液体,E的单质是固体
③F在常温下是气体,性质稳定,是除氢气外最轻的气体
④G是除氢外原子半径最小的元素
(1)A 的名称是 ,B位于周期表中第 周期第 族。
(2)C的原子结构示意图是 ,
A元素与D元素形成化合物的电子式是 。
(3)F的元素符号是 。
(4)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是 ,酸性最强的化学式是 ,气态氢化物最稳定的化学式是 。
(5)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中,反应的化学方程式是
。
Ⅱ、(1)下表中的实线表示元素周期表部分边界,请用实线画出周期表未完成的边界及金属元素与非金属元素的分界线。
(2)把符合下列要求的元素的元素符号标在表中对应位置处。
① 最高价氧化物的水化物碱性最强(放射性元素除外)
② 气态氢化物最稳定的非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
实验是化学研究的基础。对下列实验的现象描述不正确的是


A、实验①溶液不褪色
B、实验②溶液褪色
C、装置③用于石油的分馏
D、实验④饱和碳酸钠溶液上方出现油状液体
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在人类生活中扮演着重要角色,以下说法或应用正确的是 ( )
A.皂化反应指酯类物质发生碱性水解
B.光导纤维和合成纤维都属于有机高分子材料
C.苯、汽油、无水乙醇都是纯净物
D.煤经气化和液化两个化学变化过程,可变为清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.下列有关说法不正确的是___ _____。
_____。
A.相同类型的离子晶体,晶格能越大,形成的晶体越稳定
B.NH3和H3O+是等电子体,因此结构都是三角锥形
C.邻羟基苯甲醛沸点低于对羟基苯甲醛,原因是前者存在分子内氢键后者存在
分子间氢键
D.H3O+、HF2-和[Ag(NH3)2]+中均存在配位键
Ⅱ.碳及其化合物在自然界中广泛存在。
(1)基态碳原子的价电子排布图可表示为 。第四周期与其有相同
未成对电子数的过渡金属有 (填元素符号)
(2)第一电离能:C、N、O、F四种元素由大到小顺序___ _ ,
原因是 ,
HCN、NF3分子构型分别是 。
(3)冰晶胞中水分子的空间排列方式与金刚石晶胞类似。每个冰晶胞平均占有________个水分子,冰晶胞与金刚石晶胞排列方式相同的原因是__________________________。
(4)C60的晶体中,分子为面心立方堆积,已知晶胞中C60分子中心间的最短距离为
d cm,可计算C60晶体的密度为________g/cm3。
(5)请写出一个反应方程式以表达出反应前碳原子的杂化方式为sp2,反应后变为sp3:________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com