

| A. | 汽车尾气是导致酸雨的原因之一 | B. | 酸雨会使土壤、湖泊酸化 | ||
| C. | 酸雨形成中不涉及氧化还原反应 | D. | 燃煤中加入石灰石可防治酸雨 |
分析 A.工厂化石燃料燃烧的废气和汽车尾气中的二氧化硫和氮氧化物是形成酸雨的主要物质;
B.酸雨具有酸性,能腐蚀建筑物和破坏农作物,使土壤、湖泊酸化;
C.硫酸型酸雨形成是含硫燃料燃烧生成二氧化硫,二氧化硫被氧化为三氧化硫,三氧化硫溶于水生成硫酸,其中生成二氧化硫、三氧化硫的反应是氧化还原反应,氮氧化物二氧化氮溶于水生成硝酸和一氧化氮,发生的是氧化还原反应;
D.煤燃烧产物中含二氧化硫,加入石灰石后将S元素转化为硫酸钙,减少二氧化硫的排放.
解答 解:A.汽车尾气中含有二氧化硫和氮氧化物,二氧化硫和氮氧化物是形成酸雨的主要物质,所以汽车尾气是形成酸雨的原因之一,故A正确;
B.酸雨具有酸性,能腐蚀碳酸盐、硅酸盐建造的建筑物,能破坏农作物的生长环境,落入土壤、湖泊使土壤、湖泊酸化,故B正确;
C.图中分析可知,硫酸型酸雨形成是含硫燃料燃烧生成二氧化硫,二氧化硫被氧化为三氧化硫,三氧化硫溶于水生成硫酸,其中生成二氧化硫、三氧化硫的反应是氧化还原反应,2SO2+O2=2SO3是氧化还原反应,氮氧化物二氧化氮溶于水生成硝酸和一氧化氮,3NO2+H2O=2HNO3+NO,发生的是氧化还原反应,酸雨形成中涉及氧化还原反应,故C错误;
D.煤燃烧产物中含二氧化硫,加入石灰石后将S元素转化为硫酸钙,减少二氧化硫的排放,则燃煤中加入石灰石可起到脱硫作用,故D正确;
故选C.
点评 本题考查了酸雨的形成及危害,难度不大,知道形成酸雨的主要物质是二氧化硫和氮氧化物,化石燃料燃烧和脱硫过程的分析,题目较简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 某学生利用下面实验装置探究盐桥式原电池的工作原理.按照实验步骤依次回答下列问题:
某学生利用下面实验装置探究盐桥式原电池的工作原理.按照实验步骤依次回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
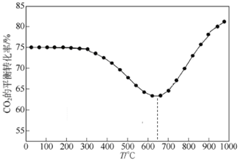 CO2是自然界中碳循环的主要载体,维持大气中CO2的平衡对生态环境有重要意义.
CO2是自然界中碳循环的主要载体,维持大气中CO2的平衡对生态环境有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
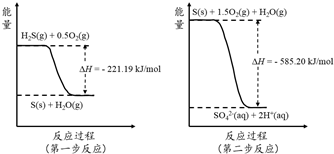
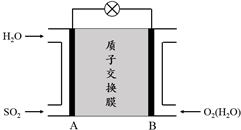
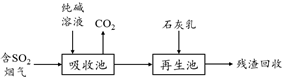
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
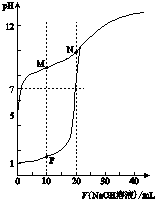 用0.1mol•L-1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:
用0.1mol•L-1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2+2H2O═2Na++2OH-+H2↑ | B. | 2O22-+4H+═4OH-+O2↑ | ||
| C. | Na2O2+2H2O═2Na++2OH-+O2↑ | D. | 2Na2O2+2H2O═4Na++4OH-+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中滴加氨水,会产生白色沉淀,再加入NaHSO4,沉淀不消失 | |
| B. | 浓的NaOH溶液不慎溅到皮肤上,可无用大量水冲洗,再涂上硼酸或稀醋酸溶液 | |
| C. | AlCl3溶液中加入过量NaF固体,再滴加氨水,无沉淀产生说明[AlF6]3-很难电离 | |
| D. | 检验Cl-时,为了排除SO42-的干扰,可先滴加过量的Ba(NO3)2溶液后,取上层溶液,再滴加AgNO3溶液,若有白色沉淀,则表明原溶液中有Cl-存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com