
| A. | 1 mol Na2O2与2 mol NaHCO3固体混合物在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是NaOH和Na2CO3 | |
| B. | 由Na2O、Na2O2、Na2CO3.10H2O组成的混合物0.05 mol,溶于水后加入50 mL 1 mol/L的硫酸恰好完全反应,则原混合物中各成分的物质的量之比可为任意值 | |
| C. | 将mg CO和H2的混合气体在足量氧气中完全燃烧,再将燃烧后的气体用足量Na2O2充分吸收,Na2O2增重mg | |
| D. | 将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是Na2O和Na2O2 |
分析 A.碳酸氢钠不稳定,加热易分解,发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2,由于二氧化碳与氢氧化钠反应生成碳酸钠,可以认为过氧化钠先与二氧化碳反应,再与水反应;
B.根据物质的性质,写出对应的化学方程式,设出未知量,找出它们的关系,然后求出未知量;
C.利用差量法,根据化学方程式分析:CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应.
2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,
质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知,反应后固体增加的质量为氢气质量;
D.由于不知道钠和氧气反应的产物为Na2O还是Na2O2或二者都有,因此可设定氧化物的化学式为Na2OX,计算出其摩尔质量,然后与两种氧化物的摩尔质量进行对比即可判断.
解答 解:A.由方程式:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,可知2mol NaHCO3分解得到Na2CO3、CO2和H2O各1mol,还会发生反应:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2,由于二氧化碳与氢氧化钠反应生成碳酸钠,可以认为过氧化钠先与二氧化碳反应,再与水反应,Na2O2只有1mol,恰好和CO2反应生成1molNa2CO3和O2,气体排出后,只剩余Na2CO3,故A错误;
B.Na2O+H2O=2NaOH
x 2x
2Na2O2+2H2O=4NaOH+O2
y 2y
2NaOH+H2SO4=Na2SO4+2H2O
2(x+y) (x+y)
Na2CO3 +H2SO4=Na2SO4+H2O+CO2
0.05-x-y (0.05-x-y)
所以2(x+y)+2(0.05-x-y)=0.05×2 解得 0.1=0.1 (说明与物质的量之比无关),原混合物中各成分的物质的量之比可为任意值,故B正确;
C.2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知,反应后固体增加的质量为氢气质量.所以将mgCO和H2的混合气体在足量氧气中充分燃烧后的产物立即通入盛有足量Na2O2的反应管,固体质量增重为mgCO和H2的混合气体的质量,故C正确;
D.反应消耗的氯化氢的物质的量为:n(HCl)=0.08L×0.50mol/L=0.04mol,
溶液恰好能被80mL浓度为0.5mol/L的HCl溶液中和,设钠与氧气反应生成的氧化物为Na2OX,
则:Na2OX~2NaOH~2HCl
0.02mol 0.04mol
Na2OX平均摩尔质量为:M=$\frac{1.5g}{0.02mol}$=75g/mol,介于Na2O(62g/mol)和Na2O2(78g/mOl)之间,
所以反应产物为Na2O和Na2O2的混合物,故D正确;
故选A.
点评 本题考查混合物的计算、根据化学方程式找出已知量和未知量的关系列比例式求解问题的能力、物质的性质和定量计算等知识,注意从CO2、H2O与Na2O2生成固体质量的变化分析规律,这是解答该题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:X<Y<W | |
| B. | Y、Z两种元素的氧化物均具有两性 | |
| C. | Z、W形成化合物的电子式为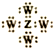 | |
| D. | X、W分别形成的氢化物中所含化学键种类相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅单质广泛用于制造制作光导纤维 | |
| B. | 次氯酸钠具有强氧化性,可用于配制“84”消毒液 | |
| C. | 小苏打可用于治疗胃酸过多 | |
| D. | 过氧化钠可用于潜水艇的氧气来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤ | B. | ②④⑤ | C. | ④⑤⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3 的电离:NaHCO3═Na++H++CO32- | |
| B. | HS-的电离:HS-+H2O?H3O ++S2- | |
| C. | NaClO的电离:NaClO?Na++ClO- | |
| D. | NH4Cl水解方程式 NH4++H2O═NH3•H2O+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂分子中都含有碳碳双键 | B. | 葡萄糖分子中含有羟基和醛基 | ||
| C. | 水分子中含有羟基 | D. | 乙酸乙酯分子中含有羧基 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碘化钾溶液中加入浓溴水2I-+Br2═2Br-+I2 | |
| B. | 小苏打与盐酸反应CO32-+2H+═CO2↑+H2O | |
| C. | 氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com