
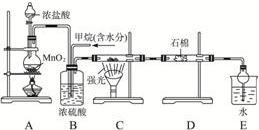
| V(Cl2) |
| V(CH4) |
| 光照 |
| 光照 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、配位数为6 |
| B、配体为NH3和Cl- |
| C、[Zn(NH3)4]2+为内界 |
| D、Zn2+和NH3以离子键结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝箔在空气中受热熔化,并不滴落,说明铝与氧气没有发生化学反应 |
| B、NH3+H3O+═NH4++H2O说明结合H+的能力:H2O>NH3 |
| C、FeCl2、Fe(OH)3均可通过化合反应制得 |
| D、分子式为C2H4O2的化合物只能电离,不能水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol?L-1) | 0.2 | 0.1 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
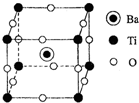 钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等邻域.下面是用金红石(主要成分为TiO2)制备金属钛和钛酸钡的流程.
钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等邻域.下面是用金红石(主要成分为TiO2)制备金属钛和钛酸钡的流程.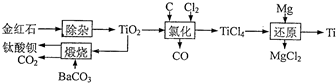
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室需要0.80mol?L-1 NaOH溶液475mL和0.40mol?L-1硫酸500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.80mol?L-1 NaOH溶液475mL和0.40mol?L-1硫酸500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 在一密闭体系中发生下列反应A(g)+3B(g)?2C(g)△H<0,如图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:
在一密闭体系中发生下列反应A(g)+3B(g)?2C(g)△H<0,如图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com