
| A. | 只生成AgBr及AgI两种沉淀 | B. | 溶液中c(I-)≈1.0×10-9mol/L | ||
| C. | 溶液中c(Br-)≈3.0×10-5mol/L | D. | 溶液中c(Ag+)≈3.2×10-8mol/L |
分析 物质的量均为1.5×10-2mol的NaI、NaBr、NaCl和4.0×10-2mo1AgNO3混合配成1.0L水溶液,Ksp小的先转化为沉淀,则
NaI+AgNO3=AgI↓+NaNO3,
1.5×10-2mol 1.5×10-2mol
NaBr+AgNO3=AgBr↓+NaNO3,
1.5×10-2mol 1.5×10-2mol
剩余硝酸银为4.0×10-2mo1-3.0×10-2mo1=1.0×10-2mo1,
则发生NaCl+AgNO3=AgCl↓+NaNO3,NaCl过量1.5×10-2mol-1.0×10-2mol=5×10-3mol,结合Ksp(AgCl)计算.
解答 解:A.由上述分析可知,生成AgI、AgBr、AgCl沉淀,故A错误;
B.溶液中c(Ag+)=$\frac{1.6×1{0}^{-10}}{5×1{0}^{-3}}$≈3.2×10-8mol/L,则溶液中c(I-)=$\frac{1.6×1{0}^{-16}}{3.2×1{0}^{-8}}$≈5.0×10-9mol/L,故B错误;
C.溶液中c(Br-)=$\frac{4.8×1{0}^{-13}}{3.2×1{0}^{-8}}$≈1.5×10-5mol/L,故C错误;
D.由选项B可知,溶液中c(Ag+)≈3.2×10-8mol/L,故D正确;
故选D.
点评 本题考查难溶电解质的计算,为高频考点,把握发生的反应、沉淀生成及Ksp计算为解答的关键,侧重分析与计算能力的考查,Ksp小的先转化为沉淀,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
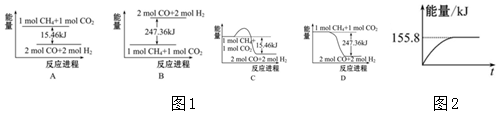
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤I中白色沉淀A的化学式为BaSO4 | |
| B. | 步骤Ⅱ中产生沉淀C的反应:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 原溶液一定含有:Na+、Fe2+、Al3+、SO42- | |
| D. | CO2先后分别与NaOH(aq)、NaAlO2( aq)反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H11Cl的有机物有8种同分异构体 | |
| B. | 塑料的老化是因为其主要成分在空气中发生了缓慢的加成反应 | |
| C. | 乙醇和乙酸都能与碳酸氢钠溶液反应 | |
| D. | 富含糖类和蛋白质的物质都易被人体消化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |||
| n(X) | n(Y) | n(M) | n(N) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0 | 0 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0 | 0 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | 0.25 | 0.25 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol•L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g•L-1) | ρ1 | ρ2 |
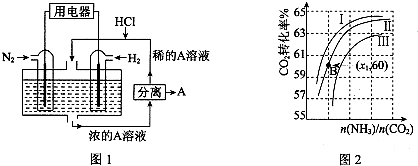
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com