
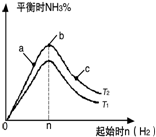
 在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;
在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;分析 (1)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)反应达到平衡后,a.升温,正逆反应速率都增大; b.加压,平衡逆向移动; c.增大c(N2),平衡正向移动,正反应速率先增大,后减少;d.降低c(NH3),平衡正向移动,所以正反应速率减小;
(3)①由图可知,n(H2)相同时,T2对应氨气含高,反应为放热反应,降低温度有利于生成氨气;
②a、b、c三点,n(H2)越大,平衡正向移动的程度越大,N2的转化率越大;
③起始体系中加入1molN2、n=3molH2,反应达到平衡时H2的转化率为60%,则转化的氢气为1.8mol,则
N2(g)+3H2(g)?2NH3(g);
开始(mol):0.05 0.15 0
变化(mol):0.03 0.09 0.06
平衡(mol):0.02 0.06 0.06
以此解答.
解答 解:(1)a.只要反应发生,就有υ(H2):υ(N2)=3:1,故错误;
b.当体系达平衡状态时,n(N2):n(NH3)可能是1:2,也可能不是,与各物质的初始浓度及转化率有关,故错误;
c.当体系达平衡状态时,c(H2):c(NH3)可能是3:2,也可能不是,与各物质的初始浓度及转化率有关,故错误;
d.容器内压强保持不变,各物质的量不变,正逆反应速率相等,故正确;
故选:d;
(2)反应达到平衡后,a.升温,正逆反应速率都增大,故正确; b.加压,平衡逆向移动,故错误; c.增大c(N2),平衡正向移动,正反应速率先增大,后减少,故错误;d.降低c(NH3),平衡正向移动,所以正反应速率减小,故错误;故选a;
(3)①由图可知,n(H2)相同时,T2对应氨气含高,反应为放热反应,降低温度有利于生成氨气,则T2<T1 ,故答案为:<;
②a、b、c三点,n(H2)越大,平衡正向移动的程度越大,N2的转化率越大,c点时氢气的物质的量最大,c点N2的转化率最高,故答案为:c;
③起始体系中加入0.05molN2、n=0.15molH2,反应达到平衡时H2的转化率为60%,则转化的氢气为1.8mol,则
N2(g)+3H2(g)?2NH3(g);
开始(mol):0.05 0.15 0
变化(mol):0.03 0.09 0.06
平衡(mol):0.02 0.06 0.06
所以平衡时N2的物质的量浓度为0.02mol•L-1,故答案为:0.02.
点评 本题考查化学平衡状态的判断、化学平衡的移动和化学平衡的计算等,题目难度中等,试题有利于培养学生的分析、理解能力及灵活应用所学知识解决实际问题的能力,有一定的难度.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | H2SO4+2NaOH═Na2SO4+2H2O | B. | CuO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$ Cu+H2O | ||
| C. | NH3+HCl═NH4Cl | D. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
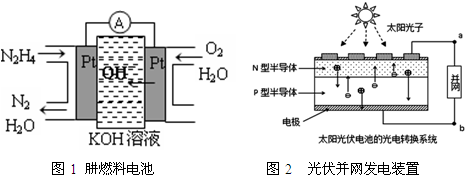
| A. | 氢氧燃料电池、太阳光伏电池中都利用了原电池原理 | |
| B. | 图1左边电极上发生的电极反应式为:N2H4-4e-+4OH-=N2+4H2O | |
| C. | 图2中N型半导体为正极,P型半导体为负极 | |
| D. | LED中的Ga和Y不可能都显+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
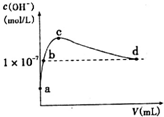 常温下,向l L pH=l0的NaOH溶液中持续通入CO2.通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述错误的是( )
常温下,向l L pH=l0的NaOH溶液中持续通入CO2.通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述错误的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10mol•L-1 | |
| B. | b点溶液中:c(H+)=1×10-7mol•L-1 | |
| C. | c点溶液中:c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止食品氧化变质,食品袋中放有硅胶包 | |
| B. | 酒精用来杀菌消毒,利用了乙醇的氧化性 | |
| C. | 植物油与矿物油可以通过水解反应区分 | |
| D. | 明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气液化以及液氨气化要吸热,所以氨常用于制冷剂 | |
| B. | 做红烧鱼时,常加一些食醋和料酒会更香,是因为生成少量的酯 | |
| C. | “地沟油”经过加工处理后可以用来制肥皂 | |
| D. | 利用生物方法脱除生活污水中的氮和磷,防止水体富营养化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | La(NO3)3水溶液显酸性 | |
| B. | LaCl3的水溶液加热蒸发灼烧,最终得到无水LaCl3 | |
| C. | La和盐酸反应的离子方程式为:La+2H+=La3++H2↑ | |
| D. | 镧有两种核素:57139La和放射性57138La,由此可知镧元素的相对原子质量为138.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的单质不存在同素异形体 | |
| B. | 单质D着火时,可用二氧化碳灭火器灭火 | |
| C. | 化合物A2B2与C2B2均只有氧化性 | |
| D. | A、B、C组成的化合物,25℃时若溶液浓度为0.1mol/L,则由水电离出的OH-为10-13mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4和SO2的反应速率可通过分光光度计用比色法测出不同反应时刻的浓度来计算. | |
| B. | 蒸馏时可用多种方法控制温度,用水浴加热分离碘并回收苯时,实验结束后,碘留在蒸馏烧瓶中. | |
| C. | 金属钾、钠和白磷等暴露在空气中易燃烧,所以金属钾、钠保存在煤油中,白磷则可保存在水中. | |
| D. | 工业上电解饱和和盐水时,从安全性和综合效率角度考虑,往往用阴离子交换膜把阳极和阴极隔开 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com