
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
| 实验 编号 | 实验目的 | T/K | pH | c/10-3mol·L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | | | | |
| ③ | | 298 | 10 | 6.0 | 0.30 |
(1)(4分)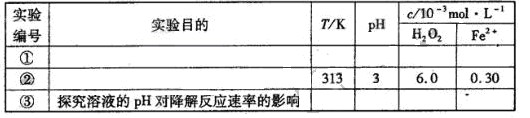
(2)8.0×10-6(2分)
(3)过氧化氢在温度过高时迅速分解。(2分)
(4)反应速率趋向于零(或该降解反应趋于停止)(2分)
(5)将所取样品迅速加入到一定量的NaOH溶液中,使pH约为10(或将所取样品骤冷等其他合理答案均可)(2分)
解析试题分析:(1)对比实验的基本思想是控制变量法,温度相同时,变化浓度,在浓度相等时,变化温度,
(2)v=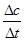 =
= =8.0×10-6 mol/(L.s);
=8.0×10-6 mol/(L.s);
(3)温度较高时,过氧化氢不稳定易分解,所以温度过高时反而导致降解反应速率减小,故答案为:过氧化氢在温度过高时迅速分解;
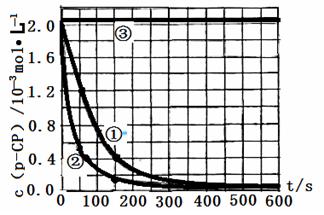
(4)通过图片知,当pH=10,随着时间的变化,其浓度基本不变,即反应速率趋向于零(或该降解反应趋于停止),故答案为:反应速率趋向于零(或该降解反应趋于停止);
(5)根据图中信息知,要想使反应停止,可以采取降低温度或改变溶液pH的方法,
考点:探究影响化学反应速率的因素


科目:高中化学 来源: 题型:计算题
一定条件下,可逆反应:A2+B2 2C达到平衡。经测定,平衡时c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L,若A2、B2和C的起始浓度分别为amol/L,bmol/L,cmol/L。
2C达到平衡。经测定,平衡时c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L,若A2、B2和C的起始浓度分别为amol/L,bmol/L,cmol/L。
请回答:
(1)a、b应满足的关系是 (2)a的取值范围是
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(7分)为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验:
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol·L-1 FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡 | 试管A中无明显气泡产生; 试管B中产生的气泡量增加 |
| ② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色先慢后快,即反应速率由小变大。小组成员为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种,并为此设计实验进行探究验证。
猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:……。
【实验目的】探究草酸与高锰酸钾反应的速率变化“异常”原因
【实验用品】仪器:试管、胶头滴管、量筒、药匙、玻璃棒等;
试剂:0.1mol/L H2C2O4溶液、0.05mol/L KMnO4(硫酸酸化)溶液等。
请你根据该兴趣小组的实验探究设计思路,补充完整所缺内容。
(1)草酸(H2C2O4,弱酸)与酸性KMnO4溶液反应的离子方程式为(已知:MnO4_还原产物是Mn2+) 。
(2)要完成对猜想Ⅰ的实验验证,至少还需要一种实验仪器是 。
(3)猜想Ⅱ可能是______________________________________________________________。要设计实验验证猜想Ⅱ,进行该实验还要补充一种试剂及一种仪器,分别是 。
(4)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容。
| | 试管A | 试管B |
| 加入试剂 | | |
| (预期)实验现象 (褪色时间) | | |
| 结论 | 猜想Ⅱ正确 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,并探究其分解反应平衡常数。反应的化学方程式: 2NH3(g)+CO2(g) NH2COONH4(s)。请按要求回答下列问题:
NH2COONH4(s)。请按要求回答下列问题:
(1)请在下图1方框内画出用浓氨水与生石灰制取氨气的装置简图。
(2)制备氨基甲酸铵的装置如下图2所示。生成的氨基甲酸铵小晶体悬浮在四氯化碳中。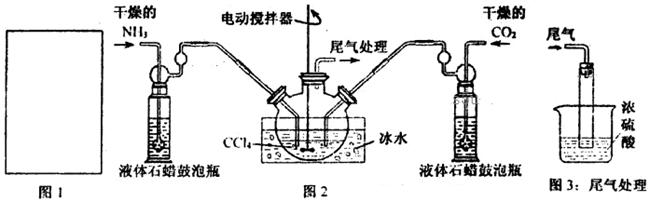
①从反应后的混合物中分离出产品的实验方法是_____________(填操作名称)。
②上图3中浓硫酸的作用是_______________________________________。
(3)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积
忽略不计),在恒定温度下使其达到分解平衡。实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
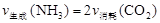
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
现甲、乙两化学小组安装两套如下相同装置,用以探究影响H2O2分解速率的因素。
(1)仪器a的名称______;检查装置气密性的操作为______。
(2)MnO2催化下H2O2分解的化学方程式是______。
(3)甲小组有如下实验设计方案,请帮助完成(所有空均需填满)。
⑷甲、乙两小组得出如图数据。
①由甲组实验II得出的数据可知:浓度越大,H2O2分解速率______;
②由乙组研究的酸、碱对H2O2分解影响因素的 数据分析:相同条件下,Na2O2和K2O2溶于水放出气体速率较快的是______;乙组提出可以用BaO2固体与H2SO4溶液反应制H2O2,其化学反应方程式为______;支持这一方案的理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分) 某同学设计了如下图所示装置(部分夹持装置已略去),该装置可以用来进行多项
实验研究。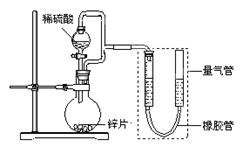
请回答:
(1)用上述装置探究影响化学反应速率的因素。
①圆底烧瓶中发生反应的离子方程式是 。
②用上述装置进行实验,以生成9.0 mL气体为计时终点,结果为t1>t2。
| 序号 | V(H2SO4)/mL | c(H2SO4)/mol·L-1 | t/s |
| Ⅰ | 40 | 1 | t1 |
| Ⅱ | 40 | 4 | t2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。正确的操作顺序是
| A.⑥③①②⑤④ | B.⑤①②⑥④③ | C.⑤④③②①⑥ | D.③①②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各溶液中,相关微粒物质的量浓度关系不正确的是
| A.0.1 mol·L-1NaHCO3溶液中:c(OH-)=c(H+)+c(H2CO3)-c(CO32-) |
| B.0.1 mol·L-1NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)=0.1 mol·L-1 |
| C.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) |
| D.常温下,浓度为0.1 mol·L-1 NaHSO3溶液的pH<7:c(Na+)>c(HSO3-)>c(SO32-)> c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com