
据国外资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nd等的磷酸盐)中,查明有尚未命名的116、124、126号元素.判断其中116号应位于周期表中的 ( )
A.第六周期ⅣA族 B.第七周期ⅥA族
C.第七周期Ⅷ族 D.第八周期ⅥA族
科目:高中化学 来源: 题型:
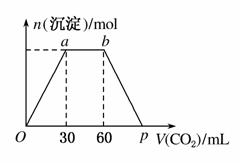
向Ba(OH)2和KOH混合液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体体积V(标准状况)的关系如图所示,下列结论中正确的是( )
A.原混合物中n[Ba(OH)2]:n(KOH)=1:2
B.p点横坐标为120
C.p点溶液中溶质为Ba(HCO3)2
D.ab段反应分两个阶段,离子方程式为:CO2+2OH-===CO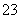 +H2O,CO
+H2O,CO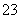 +H2O+CO2===2HCO
+H2O+CO2===2HCO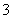
查看答案和解析>>
科目:高中化学 来源: 题型:
正确掌握化学用语和化学基本概念是学好 化学的基础。下列有关表述中正确的一组
化学的基础。下列有关表述中正确的一组 是
是
A.16O与18O互为同位素;H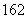 O、D
O、D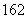 O、H
O、H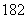 O、D
O、D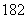 O互为同素异形体
O互为同素异形体
B.SiH4、PH3、HCl的稳定性 逐渐增强
逐渐增强
C.氧化 铁的化学式:FeO
铁的化学式:FeO
D.Ca2+的结构示意图为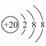 ,NH4Cl的电子式为
,NH4Cl的电子式为

查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z是短周期元素,其部分性质如下表
| W | 单质是淡黄色固体 |
| X | 在地壳中的含量居第二位 |
| Y | 原子最外层电子数是电子总数的2/3 |
| Z | 第三周期原子半径最小的金属 |
下列说法正确的是
A.气态氢化物的热稳定性:X>W B.最高价氧化物对应水化物的酸性:Y>X
C.离子半径:Z>W D.Z的氧化物中含有非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
根据原子结构及元素周期律的知识,下列推断正确的是
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B. 核外电子排布相同的微粒化学性质也相同
核外电子排布相同的微粒化学性质也相同
C. Cl‾、S2‾、Ca2+、K+半径逐渐减小
Cl‾、S2‾、Ca2+、K+半径逐渐减小
D. 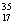 Cl与
Cl与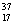 Cl得电子能力相同
Cl得电子能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
将甲、乙两种金属的性质相比较,已知①甲与H2O反应比乙与H2O反应剧烈;②甲单质能从乙的盐溶
液中置换出单质乙;③甲的最高价氧化物对应的水化物碱性比乙的最高价氧化物对应的水化物碱性强;④
与某金属反应时甲原子得电子数目比乙原子得电子数目多;⑤甲单质的熔、沸点比乙的低.能说明甲的金
属性比乙强的是 ( )
A.①④ B.①②③ C.③⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C为中学化学中常见的三种元素.其中A元素的原子失去1个电子后形成“裸露的质子”,B、C元素可形成多种化合物,原子个数比为1∶2的就有两种,且C元素的原子最外层电子数为次外层电子数的3倍.
(1)A、B、C三种元素分别为:A________,B__________,C__________.(写元素名称)
(2)由A、B两元素形成的一种常见化合物为________(填化学式),其水溶液呈________性,用方程式来解释其原因:______________________________________.
(3)B、C元素可形成多种化合物,试列举其中的三种物质的化学式为________、________、________.
(4)由A、B、C三种元素形成的化合物的化学式为______、________、________等,其中的一种物质在 浓度较大时可使Fe、Al等金属钝化,则该物质的浓溶液与Cu反应的离子方程式为_________________________________________________.
浓度较大时可使Fe、Al等金属钝化,则该物质的浓溶液与Cu反应的离子方程式为_________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在一个容积为2 L的密闭容器中加入0.8 mol A2气体和0.6 mol B2气体反应达平衡生成1mol AB气体并释放出热量,反应中各物质的浓度随时间的变化情况如图所示。下列说法不正确的是
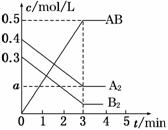
A.图中a点的值为0.15 B.该反应的平衡常数K=0.03
C.温度升高,平衡常数K值减小 D.平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量均为1 mol的下述物质,长期放置于空气中(最终物质不考虑潮解情况),最后质量增加的大小关系是  ( )
( )
①氧化钠 ②过氧化钠 ③氢氧化钠 ④亚硫酸钠
A.①=③>②>④ B.①>②>④>③
C.③>①=②>④ D.④>③>②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com