
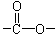 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为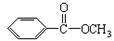 )是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠(
)是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠(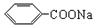 )]、甲醇为原料制备苯甲酸甲酯。已知:
)]、甲醇为原料制备苯甲酸甲酯。已知:| | 熔点 ℃ | 沸点 ℃ | 水溶性 |
| 甲醇 | —97.8 | 64.7 | 易溶 |
| 苯甲酸(一元弱酸) | 122.4 | 249.3 | 常温:0.17g;100℃:6.8g |
| 苯甲酸甲酯 | —12.3 | 198 | 难溶 |

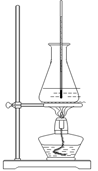
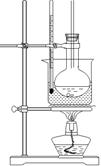
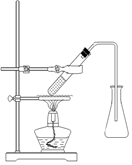
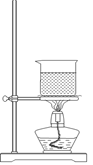
 CH3COOCH2CH3 + H2O(2分)
CH3COOCH2CH3 + H2O(2分)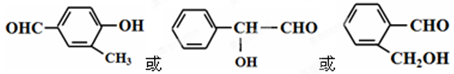 等(含有苯环、羟基、醛基,合理即可)(2分)
等(含有苯环、羟基、醛基,合理即可)(2分)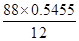 =4、
=4、 =8,则分子氧原子的个数是
=8,则分子氧原子的个数是 =2,即该有机物的化学式为C4H8O2。经红外光谱分析其中只含C-H键和
=2,即该有机物的化学式为C4H8O2。经红外光谱分析其中只含C-H键和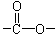 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A应该是酯类,所以结构简式为CH3COOCH2CH3。
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A应该是酯类,所以结构简式为CH3COOCH2CH3。 CH3COOCH2CH3 + H2O。
CH3COOCH2CH3 + H2O。 等。
等。

科目:高中化学 来源:不详 题型:单选题
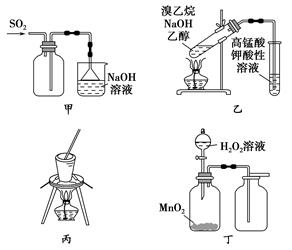
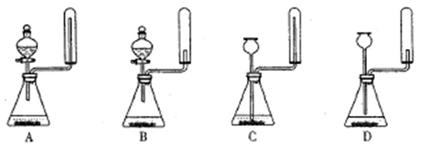
| A.用图甲所示装置收集SO2气体 |
| B.用图乙所示装置检验溴乙烷与NaOH醇溶液共热产生的乙烯 |
| C.用图丙所示装置从食盐水中提取NaCl |
| D.用图丁所示装置制取并收集O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C.加入足量稀盐酸无现象,再加入氯化钡溶液,有白色沉淀产生,一定有SO42- |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
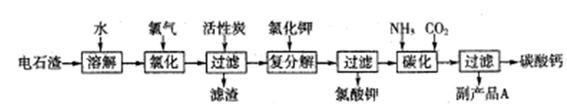
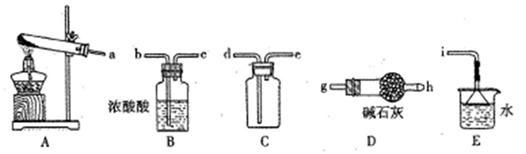
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | X | Y | Z |
| A | NaHCO3溶液 | Na2CO3 | BaCl2溶液 |
| B | FeCl3溶液 | CuCl2 | Fe |
| C | Fe2O3 | Al2O3 | NaOH溶液 |
| D | Na2SO4溶液 | Na2CO3 | 盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

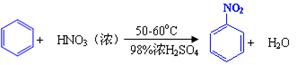
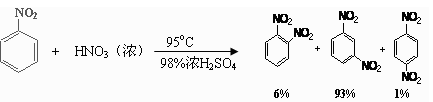
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20 ℃) / g·cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 |  | 83 | 1.4 | 易溶于水 |
| 浓硫酸 |  | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 物质 | 相对分 子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度 | |
| 水 | 乙醇 | |||||
| 1-萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
| 1-乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
| 乙醇 | 46 | 无色液体 | -114.1℃ | 78.5℃ | 任意比混溶 | |
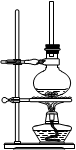
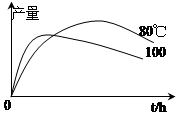
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com