
【题目】下表是元素周期表的一部分:
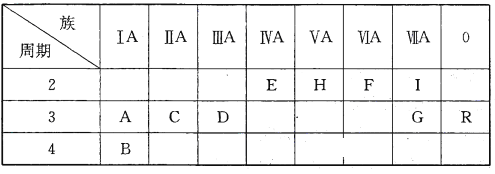
根据要求回答下列问题:
(1)十种元素中化学性质最不活泼的元素是__________________(填元素符号,下同),形成化合物种类最多的元素是_____________________。
(2)A、C、D三种元素的最高价氧化物对应的水化物,其中碱性最强的是______________(填化学式,下同),E、H、G三种元素的最高价氧化物对应的水化物中酸性最强的是______________。
(3)I元素跟A元素形成化合物的电子式是______________。高温灼烧该化合物时,火焰呈______________色。
(4)分别写出B、G两种单质和水反应的离子方程式_____________、________________。
(5)元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式:__________________________________________。
【答案】 Ar C NaOH HClO4 ![]() 黄 2K+2H2O=2K++2OH—+H2↑ Cl2+H2O=Cl—+H++HClO 2Na2O2+2CO2=2Na2CO3+O2
黄 2K+2H2O=2K++2OH—+H2↑ Cl2+H2O=Cl—+H++HClO 2Na2O2+2CO2=2Na2CO3+O2
【解析】
根据元素在周期表中的位置,首先判断出元素种类,然后根据元素周期律并结合有关物质的性质分析解答。
根据元素在周期表中的位置可知A~R分别是Na、K、Mg、Al、C、O、Cl、N、F、Ar。则
(1)十种元素中化学性质最不活泼的元素是稀有气体元素Ar。化合物中最多的是有机物,则形成化合物种类最多的元素是C。
(2)同周期自左向右金属性逐渐减弱,最高价氧化物水化物的碱性逐渐减弱,则A、C、D三种元素的最高价氧化物对应的水化物中碱性最强的是NaOH;非金属性越强,最高价含氧酸的酸性越强,E、H、G三种元素的最高价氧化物对应的水化物中酸性最强的是高氯酸,化学式为HClO4。
(3)I元素跟A元素形成化合物是NaF,含有离子键的离子化合物,电子式是![]() 。含有钠元素,则高温灼烧该化合物时,火焰呈黄色。
。含有钠元素,则高温灼烧该化合物时,火焰呈黄色。
(4)B、G两种单质分别是钾和氯气,和水反应的离子方程式分别是2K+2H2O=2K++2OH—+H2↑、Cl2+H2O=Cl—+H++HClO。
(5)元素A和F能形成两种化合物,其中较稳定的化合物与CO2反应生成氧气的是过氧化钠,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2。


科目:高中化学 来源: 题型:
【题目】下列表示化学过程的化学用语书写正确的是
A. BaSO4投入水中后建立的沉淀溶解平衡:BaSO4![]() Ba2++SO42-
Ba2++SO42-
B. AlCl3溶液与NaAlO2溶液混合:A13++A1O2-+3H2O![]() 2Al(OH)3↓
2Al(OH)3↓
C. HCO3-的电离:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D. Na2SO3的水解:SO32-+2H2O![]() H2SO3+2OH-
H2SO3+2OH-
【答案】C
【解析】选项A的平衡应该标注各物质的状态,即为:BaSO4(s)![]() Ba2+(aq)+SO42-(aq),选项A错误。选项B的电荷不守恒,应该为A13++3A1O2-+6H2O
Ba2+(aq)+SO42-(aq),选项A错误。选项B的电荷不守恒,应该为A13++3A1O2-+6H2O![]() 4Al(OH)3↓,选项B错误。将选项C的方程式两边各去掉一个水分子,即得到:HCO3-
4Al(OH)3↓,选项B错误。将选项C的方程式两边各去掉一个水分子,即得到:HCO3-![]() CO32-+H+,表示的是碳酸氢根的电离,选项C正确。亚硫酸根离子的水解应该分步进行,选项D错误。
CO32-+H+,表示的是碳酸氢根的电离,选项C正确。亚硫酸根离子的水解应该分步进行,选项D错误。
【题型】单选题
【结束】
17
【题目】下列生活中的化学现象解释不正确的是
A. 生石灰可作食品速热剂是利用原电池原理
B. 泡沫灭火器是运用双水解原理产生CO2
C. 铝盐可作净水剂是利用铝离子水解产生胶体
D. 将煤气中毒的人移到通风处,是运用平衡理论
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
【答案】D
【解析】石墨电极为惰性电极,溶液中阳离子在阴极放电,阴离子在阳极放电。A、电解AgNO3溶液,Ag+在阴极放电生成Ag,OH-在阳极放电生成O2,且n(Ag)∶n(O2)=2∶1,则应加入Ag2O恢复浓度,故A错误;B、电解NaOH溶液,H+在阴极放电生成H2,OH-在阳极放电生成O2,且n(H2)∶n(O2)=2∶1,则应加入一定量的H2O恢复原样,故B错误;C、电解KCl溶液,H+在阴极放电生成H2,Cl-在阳极放电生成Cl2,且n(H2)∶n(Cl2)=1∶1,则应加入一定量HCl恢复原样,故C错误;D、电解CuSO4溶液,Cu2+在阴极放电生成Cu,OH-在阳极放电生成O2,且n(Cu)∶n(O2)=2∶1,则应加入一定量CuO恢复原样,故D正确。故选D。
点睛:分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,根据元素守恒和原子比例,加入对应的物质,即可使溶液完全复原。
【题型】单选题
【结束】
28
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
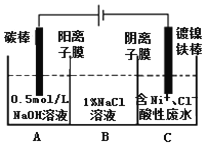
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向体积为2 L的恒容密闭容器中加入足量铁粉和0.08 mol H2O(g),发生反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是( )
Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是( )
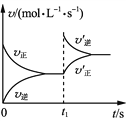
A. t1时刻充入H2,v′正、v′逆变化如右图
B. 第一次达平衡时,H2的体积分数小于20%
C. 温度为T时,起始向原容器中充入0.1 mol铁粉、0.04 mol H2O(g)、0.1 mol Fe3O4(s)、0.005 mol H2(g),反应向正反应方向进行
D. 温度为T时,向恒压容器中加入足量Fe3O4(s)和0.08 mol H2 (g),达平衡时H2(g)转化率为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

反应结束后,先分离出甲醇,再加入乙醚,将获得的有机层(含少量氯化氢)进行洗涤,然后分离提纯得到产物。甲醇和3,5-二甲氧基苯酚的部分物理性质见下表,下列说法正确的是
物质 | 沸点/℃ | 熔点/℃ | 溶解性 |
甲醇 | 64. 7 | ﹣97.8 | 易溶于水 |
3,5-二甲氧基苯酚 | 172~175 | 33~36 | 易溶于甲醇、乙醚,微溶于水 |
A. 上述合成反应属于取代反应
B. 间苯三酚与苯酚互为同系物
C. 分离出甲醇的操作是结晶
D. 洗涤时可以用饱和Na2CO3溶液除氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑灰的主要成分是硫化钡(BaS),常用于制取氧化钡等钡盐。
I.工业上常用如下方案测定黑灰中BaS含量:
步骤:准确称取一定质量黑灰试样置于烧杯中,加入适量的蒸馏水使黑灰充分溶解。
步骤2:过滤并洗涤残留固体2~3次,将滤液、洗涤液合并后完全转移至500mL容量瓶中,加水定容。
步骤3:取20.00mL步骤2中溶液于锥形瓶中,再迅速加入10mL2%醋酸稀溶液及25.00mL 0.5mo1/L碘标准溶液(过量),充分振荡,使BaS完全转化为S。
步骤4向锥形瓶中加入2-3滴淀粉溶液,用0.1mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液体积VmL(I2+2S2O32-=2I-+S4O62-)。
步骤5....
步骤6数据处理,计算黑灰中BaS含量。
(1)步骤2实验中所需的玻璃仪器有烧杯、漏斗.500mL容量瓶、_______。
(2)步骤4到达滴定终点时,滴定管中液面如图所示,此时滴定管读数为____mL。若盛装Na2S2O3标准溶液的滴定管未润洗,则所测得的BaS含量将会_______(填“偏高”、“偏低"或“不变”)。

(3)为保证实验结果的准确性,步骤5应为_______________。
II.氯化钡可用于测定煤矿酸性矿井水中硫酸盐的含量。
(1)酸性矿井水(主要含有H+、Fe2+、SO42-)是煤层中夹杂的硫铁矿(FeS2)被空气中氧气氧化所致,该反应的离子方程式为_______________。
(2)查阅资料发现铁元素的存在对SO2含量(mg/L)的测定结果影响较大。请补充完整测定酸性矿井水中SO42-含量的实验步骤:量取一定体积的酸性矿井水,________,根据采集的数据计算废水中SO42-含量。
(实验中须使用的试剂有:稀氨水、30%双氧水、1mol/LBaCl2溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO和O2经反应①和反应②转化为NO2,其能量变化随反应进程的图示如下。

①2NO(g)![]() N2O2(g)△H1平衡常数K1
N2O2(g)△H1平衡常数K1
②N2O2(g)+O2(g)![]() 2NO2(B)△H2平衡常数K2
2NO2(B)△H2平衡常数K2
下列说法不正确的是( )
A. △H1<0,△H2<0
B. 2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K=K1/K2
2NO2(g)的平衡常数K=K1/K2
C. 表示2NO(g)+O2(g)![]() 2NO2(g)的△H=△H1+△H2
2NO2(g)的△H=△H1+△H2
D. 反应②的速率大小决定2NO(g)+O2(g)![]() 2NO2(g)的反应速率
2NO2(g)的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金是一类用途广泛的金属材料,下列关于合金的描述正确的是( )
A.合金的硬度比组成它的成分金属小
B.在我国,使用最早的合金是青铜
C.合金的熔点一般比组成它的成分金属高
D.目前用量最大、用途最广的合金是铝合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,对于等质量的SO2和CO2两种气体,求其下列各项比值。
(1)摩尔质量比___________;
(2)密度比___________;
(3)物质的量比___________;
(4)体积比为___________;
(5)分子数比___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com