
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
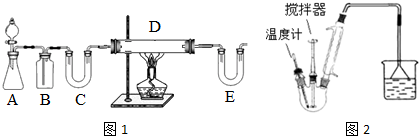
分析 I.按如图1装置可知,用H2还原无水FeCl3制取无水FeCl2,A装置一般用锌和稀盐酸制备H2,B装置用来除去氢气中的氯化氢,C装置用来干燥氢气,可以装置碱石灰,E装置中也要装置碱石灰,防止空气中的水份进入D装置,D装置中用氢气与氯化氯生成氯化亚,据此答题;
II.(3)根据反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl可知,氯苯能使氯化铁生成氯化亚铁,所以氯苯为还原剂;
(4)根据图2可知,装置有冷凝回流装置,所以为了提高反应速率,可以将反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失;
(5)三颈瓶内物质为氯化亚铁、C6H5Cl、C6H4Cl2,根据其溶解性可知,可以用有机溶剂将C6H5Cl、C6H4Cl2溶解,过滤后可得氯化亚铁,对滤液进行蒸馏可回收C6H5Cl,据此答题;
(6)根据反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl,利用氯化氢的量可判断氯化铁转化率,要确定生成氯化氢的量,可在烧杯中加入一定量的氢氧化钠,并用酚酞作指示剂进行判断反应进行的程度.
解答 解:I.按如图1装置可知,用H2还原无水FeCl3制取无水FeCl2,A装置一般用锌和稀盐酸制备H2,B装置用来除去氢气中的氯化氢,C装置用来干燥氢气,可以装置碱石灰,E装置中也要装置碱石灰,防止空气中的水份进入D装置,D装置中用氢气与氯化氯生成氯化亚,据此答题;
(1)根据上面的分析可知,装置C的作用是 干燥氢气;E中盛放的试剂是 碱石灰;D中反应的化学方程式为H2+2FeCl3$\frac{\underline{\;加热\;}}{\;}$2FeCl2+2HCl,
故答案为:干燥氢气;碱石灰;H2+2FeCl3$\frac{\underline{\;加热\;}}{\;}$2FeCl2+2HCl;
(2)温度控制不当,产品中含单质铁.检验产品中是否含铁的方案为取样,加入盐酸中,观察是否有气泡产生,
故答案为:取样,加入盐酸中,观察是否有气泡产生;
II.(3)根据反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl可知,氯苯能使氯化铁生成氯化亚铁,所以氯苯为还原剂,
故答案为:C6H5Cl;
(4)根据图2可知,装置有冷凝回流装置,所以为了提高反应速率,可以将反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失,
故答案为:实验使用了冷凝回流装置;
(5)三颈瓶内物质为氯化亚铁、C6H5Cl、C6H4Cl2,根据其溶解性可知,可以用有机溶剂例如苯将C6H5Cl、C6H4Cl2溶解,过滤后可得氯化亚铁,对滤液进行蒸馏可回收C6H5Cl,
①洗涤所用的试剂可以是苯;
故答案为:苯;
②回收滤液中C6H5Cl的方案是蒸馏滤液,并收集132℃馏分,
故答案为:蒸馏滤液,并收集132℃馏分;
(6)根据反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl,氯化铁转化率达到或超过90%,则可产生氯化氢的物质的量为$\frac{162.5g}{162.5g/mol}×0.9×\frac{1}{2}$=0.45mol,所以可在烧杯中加入0.45×40g的氢氧化钠即18g,并用酚酞作指示剂进行判断反应进行的程度,如果18g氢氧化钠完全反应,则产率达到或超过90%,
故答案为:滴有酚酞且含18g NaOH的溶液.
点评 本题考查实验室制备氯化亚铁的方案设计与评价,题目难度较大,本题注意把握实验操作原理,把握题给信息,掌握实验操作方法,学习中注意积累.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 其中:
其中:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定温度下,1L的密闭容器内某一反应M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )
在一定温度下,1L的密闭容器内某一反应M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )| A. | t1时,N的浓度是M的浓度的2倍 | |
| B. | t2时,正逆反应速率相等,反应达到平衡 | |
| C. | t3时,正反应速率大于逆反应速率 | |
| D. | 反应的化学方程式为:M?2N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 6种 | C. | 8种 | D. | 10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体成分相同 | |
| B. | 1L 1mol/L的Na2S溶液中Na与S2-数目总和小于3NA(NA表示阿伏加德罗常数) | |
| C. | NH4Cl溶液加水稀释后,恢复至原温度,pH和Kw均增大 | |
| D. | 常温下,向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗衣净的沉淀中加稀盐酸,有气泡产生,因此Ksp(BaSO4)>Ksp(BaCO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
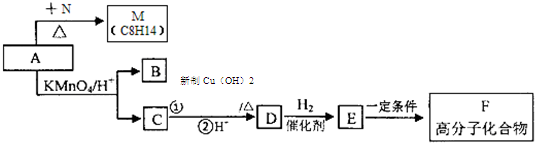
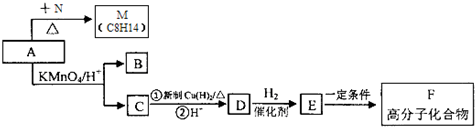
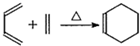
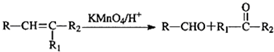
 ,写出属于A的同一类别物质且存在顺反异构的有机物结构简式CH3CH=CHCH=CH2.
,写出属于A的同一类别物质且存在顺反异构的有机物结构简式CH3CH=CHCH=CH2. .
.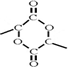 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | b是电池的负极 | |
| B. | HS-在硫氧化菌作用下转化为SO42-的反应是:HS-+4H2O-8e-═SO42-+9H+ | |
| C. | 该电池在高温下进行效率更高 | |
| D. | 若该电池有0.4 mol 电子转移,则有0.45 mol H+通过质子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
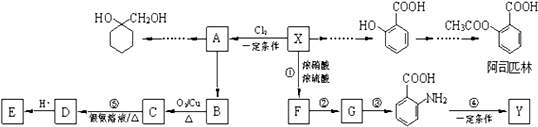
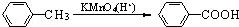
 (苯胺,易被氧化)
(苯胺,易被氧化) 中官能团的名称为酚羟基、羧基;
中官能团的名称为酚羟基、羧基; ;
;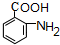 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$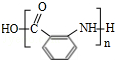 +(n-1)H2O;
+(n-1)H2O;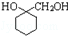 的合成路线流程图 (无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路线流程图 (无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com