
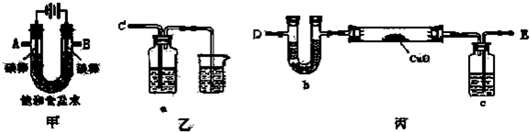
分析 (1)在电解池的阴极上产生的是氢气,阳极上产生的是氯气,据实验目的来连接装置;
(2)电解饱和食盐水产生的氢气中含有水蒸气,会影响铜的相对原子质量的测定,需进行干燥,检验纯度;
(3)氯气具有氧化性,能使湿润的淀粉碘化钾试纸变蓝;
(4)①乙方案中,装置中U型管也可能吸收空气中的CO2和水,影响测定结果;
②设出铜的原子量,利用关系式CuO~Cu及甲方案中的数据进行计算Cu的相对原子质量.
解答 解:(1)A是阴极,阴极上产生的是氢气,B是阳极,阳极上产生的是氯气,要用氢气来还还原氧化铜,所以A连接E,干燥氢气后用氢气来还原氧化铜,所以B连接C,
故答案为:E;C;
(2)加热氧化铜之前要检验纯度,否则加热易引起爆炸,
故答案为:检验氢气的纯度;
(3)氯气具有氧化性,能使湿润的淀粉碘化钾试纸变蓝,可以用湿润的淀粉碘化钾试纸来检验,
故答案为:淀粉碘化钾溶液,溶液变为蓝色;
(4)①在乙方案中,应用装置中U型管也可能吸收空气中的CO2和水,会导致测定Cu的相对原子质量有误差,所以乙方案不合理,
故答案为:乙方案不合理,因为空气中的CO2和H2O通过D口进入U型管,造成实验误差较大;
②根据甲方案,设金属铜的原子量为M,则
CuO~Cu
M+16 M
b-a c-a
则:$\frac{M+16}{b-a}$=$\frac{M}{c-a}$,
解得:M=$\frac{16(c-a)}{b-c}$,故答案为:$\frac{16(c-a)}{b-c}$.
点评 本题考查了化学实验基本操作方法及其应用,题目难度中等,明确实验目的为解答关键,试题知识点较多,充分考查了学生的分析、计算能力及化学实验能力.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | N2O4(g)═2NO2(g),改变某一条件后,气体颜色加深 | |
| B. | H2(g)+I2(g)═2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2 | |
| C. | N2(g)+3H2(g)═2NH3(g),改变某一条件后,NH3的体积分数增加 | |
| D. | 2SO2(g)+O2(g)═2SO3(g),恒温恒压条件下,充入He |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K1=K2 | B. | K1<K2 | C. | K1>K2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定:
某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定:| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 实验次数 温度 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③④ | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{17}O$原子核内含有8个中子 | B. | ${\;}_{8}^{17}O$原子核内含有8个质子 | ||
| C. | ${\;}_{8}^{17}O$原子核外有17个电子 | D. | ${\;}_{8}^{17}O$原子核内含有17个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
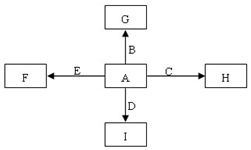 图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:①反应C+G$\stackrel{高温}{→}$B+H能放出大量的热,该反应曾应用于铁轨的焊接;
图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:①反应C+G$\stackrel{高温}{→}$B+H能放出大量的热,该反应曾应用于铁轨的焊接; ,它的空间构型是直线型;
,它的空间构型是直线型;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com