
用8.7 g MnO2和10 mol·L-1的盐酸120 mL反应制取Cl2。
(1)在标准状况下可生成多少升氯气?
(2)若把反应后的剩余溶液稀释成1 L后,取出20 mL(不考虑HCl损失),在这20 mL溶液中加入足量AgNO3溶液,可得AgCl多少克?
(1)2.24 L。 (2)2.87 g。
[解析] (1) ,n (HCl)=10 mol·L-1×0.12 L=1.2 mol。
,n (HCl)=10 mol·L-1×0.12 L=1.2 mol。
MnO2 + 4HCl (浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1 4
0.1 mol 1.2 mol
盐酸过量,依MnO2的量来计算。n (Cl2)=n (MnO2)=0.1 mol,故V (Cl2)=0.1 mol×22.4 L·mol―1=2.24 L。
(2)由(1)可知n (Cl2)=0.1 mol,根据氯元素守恒,有:
n (Cl―)=n (HCl)―2n (Cl2)=1.2 mol―2×0.1 mol=1 mol。
在20 mL溶液中,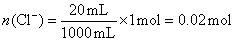 。
。
依Cl―~AgCl,有:n (AgCl)=n (Cl―)=0.02 mol。
故m (AgCl)=0.02 mol×143.5 g·mol-1=2.87 g。


科目:高中化学 来源: 题型:
可逆反应:N2(g)+3H2 (g) 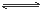 2NH3(g)的正、逆反应速度可用各反应物或生成物浓度变化来表示。下列各关系中能说明反应已经达到化学平衡的是 ( )
2NH3(g)的正、逆反应速度可用各反应物或生成物浓度变化来表示。下列各关系中能说明反应已经达到化学平衡的是 ( )
A.3v正(N2)=v逆(H2)
B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v正(NH3)
D.v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
根据Cl2的化学性质写出下列反应的化学方程式。
(1)I2与NaOH溶液反应:________。
(2)Br2与H2O反应:____________。
(3)I2与Fe反应(已知氧化性:Fe3+>I2>Fe2+):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项操作中,错误的是( )
A.用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液
B.进行分液时,分液漏斗中的下层液体从下口流出,上层液体从上口倒出
C.萃取分液前需对分液漏斗检漏
D.为保证分流漏斗内的液体顺利流出,需将上面的塞子拿下
查看答案和解析>>
科目:高中化学 来源: 题型:
在中学实验中学过的可用于分离或提纯物质的方法很多,如结晶、过滤、蒸发……请填写分离或提纯下列各混合物最适宜的方法的名称。
(1)除去氯化钠固体中混有的碳酸氢铵________。
(2)除去乙醇中溶解的少量食盐________。
(3)分离碘的饱和水溶液________。
(4)除去粗盐中的泥沙________。
(5)从海水中提取食盐________。
(6)分离油和水________。
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是( )
A.碳酸氢钙溶液和氢氧化钠溶液混合:HCO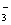 +OH
+OH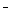 ==CO
==CO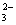 +H2O
+H2O
B.醋酸钠溶液和盐酸混合:CH3COONa+H+ == CH3COOH + Na+
C.氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O
D.硫酸铜溶液和氢氧化钡溶液混合:Cu2+ + SO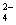 +Ba2+ + 2OH
+Ba2+ + 2OH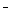 == Cu(OH)2↓+ BaSO4↓
== Cu(OH)2↓+ BaSO4↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com