
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题
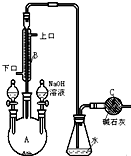 制备溴苯的实验装置如右图所示,请回答下列问题:
制备溴苯的实验装置如右图所示,请回答下列问题: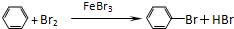 .
. +Br+→[
+Br+→[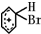 ];[
];[ ]+FeBr4-→
]+FeBr4-→ +HBr+FeBr3.由上述反应可推知:
+HBr+FeBr3.由上述反应可推知: +Br2→
+Br2→ +HBr 中的催化剂为BD.(填字母)
+HBr 中的催化剂为BD.(填字母)查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
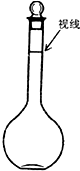 实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:
实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9m~10-7m之间 | |
| B. | 用平行光照射NaCl溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液与NaOH溶液混合,以制取Fe(OH)3胶体 | |
| D. | 除去Fe(OH)3胶体中的H+、Cl-,可用渗析的实验方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com