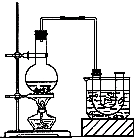
某化学课外小组同学在实验室做酸碱中和滴定实验,他们准确移取25.00ml某未知浓度的盐酸溶液于一洁净锥形瓶中,然后用0.2000mol/LNaOH溶液滴定(指示剂为酚酞).滴定结果如下:
| NaOH溶液起始读数 | NaOH溶液终点读数 |
| 第一次 | 0.02mL | 18.60mL |
| 第二次 | 0.04mL | 18.66mL |
| 第三次 | 0.20mL | 20.60mL |
(1)根据以上数据可计算出盐酸的物质的量浓度为
mol/L.(精确到0.0001)
(2)下列有关滴定的操作正确的顺序是
①用标准液润洗滴定管
②往滴定管中注入标准溶液
③检查滴定管是否漏水
④滴定
⑤加水洗涤
A.⑤①③②④B.③⑤①②④C.⑤②③①④D.②①③⑤④
(3)若操作有误,则导致待测盐酸溶液浓度偏低的错误操作是
A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液
B.滴定前滴定管尖端有气泡,滴后气泡消失
C.滴定管读数时,滴定前仰视滴定后俯视
D.待测液中指示剂酚酞(为有机弱酸)加得太多
(4)如果准确移取25.00mL 0.2000mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?
填“是”或“否”)
(5)另一小组同学用标准盐酸滴定未知浓度的NaOH溶液,若测定结果偏高,则产生误差的原因可能是
A.滴定时,装NaOH溶液的锥形瓶未用NaOH溶液润洗
B.酸式滴定管用蒸馏水洗后,未用标准盐酸润洗
C.滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失
D.配置NaOH溶液时,NaOH固体中混有少量KOH固体.



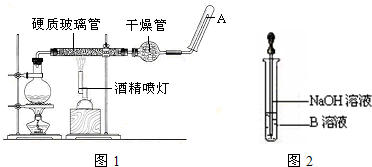
 已知:CH3CH2OH+NaBr+H2SO4(浓)
已知:CH3CH2OH+NaBr+H2SO4(浓)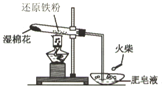 为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.
为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.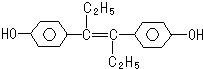
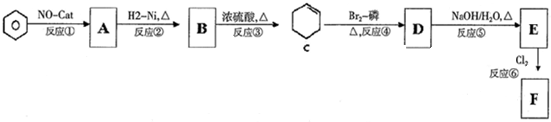
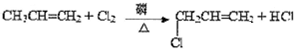 F的结构简式为
F的结构简式为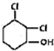
 直接制
直接制 ,理由是
,理由是