
| A、N2 |
| B、N2O |
| C、NO |
| D、NO2 |
| 8.8g |
| 88g/mol |
| 1 |
| 3 |
| 0.1 |
| 3 |
| 0.2mol |
| 3 |
| 0.1mol |
| 3 |
| 0.1mol |
| 3 |
| 8.8g |
| 88g/mol |
| 1 |
| 3 |
| 0.1 |
| 3 |
| 0.2mol |
| 3 |
| 0.1mol |
| 3 |
| 0.1mol |
| 3 |


科目:高中化学 来源: 题型:
| A、正极反应:O2+2H2O+4e-═4OH- |
| B、发生氧化反应的是负极 |
| C、当正极消耗22.4LH2时,负极11.2LO2消耗(相同条件) |
| D、氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
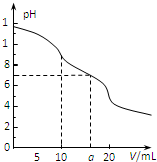 常温下,用 0.1mol?L-1 HCl溶液滴定10.0mL浓度为0.1mol?L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
常温下,用 0.1mol?L-1 HCl溶液滴定10.0mL浓度为0.1mol?L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )| A、当V=0时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-) |
| B、当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-) |
| C、当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| D、当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应达到平衡时,放出的热量等于92.4kJ |
| B、达到平衡后向容器中通入1mol氦气,平衡正向移动 |
| C、若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的80% |
| D、若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的90% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解过程中阴极析出的气体和阳极析出的气体可能一样多 |
| B、阳极先析出氯气后析出氧气 |
| C、电解最后阶段为电解水 |
| D、电解过程中溶液的pH不断增大,最后pH为7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
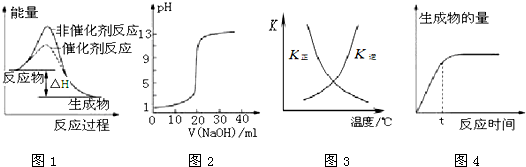
| A、图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B、图2表示0.1000 mol?L-1NaOH溶液滴定20.00mL 0.1000 mol?L-1CH3COOH溶液所得到的滴定曲线 |
| C、图3表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 |
| D、图4 表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成44.8 L N2(标准状况) |
| B、有0.250 mol KNO3被氧化 |
| C、转移电子的物质的量为1.25 mol |
| D、被氧化的N原子的物质的量为3.75 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑤⑦ | B、③④⑥ |
| C、①②⑦ | D、③④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 举办“人文亚运”的一个重要体现就是禁止运动员服用兴奋剂.有一种兴奋剂的结构简式如图,下列有关该物质的说法不正确的是( )
举办“人文亚运”的一个重要体现就是禁止运动员服用兴奋剂.有一种兴奋剂的结构简式如图,下列有关该物质的说法不正确的是( )| A、该分子的化学式为C20H24O3 |
| B、该物质能使酸性KMnO4溶液褪色,不一定能证明其分子必存在碳碳双键 |
| C、1 mol该物质与足量浓溴水反应时,至少消耗4 mol Br2 |
| D、该物质属于苯酚的同系物,遇到FeCl3溶液有可能发生显色反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com