
| A、加入铝粉能放出氢气的溶液:Na+、Cl-、SO42-、Fe3+ |
| B、使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
| C、c(OH-)=10-12 mol?L-1的溶液:K+、Ba2+、Cl-、Br- |
| D、在含有大量AlO2-的溶液中:NH4+、Na+、Cl-、H+ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
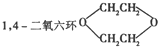 是一种常见的溶剂,它可以通过以下方法制得:A(烃类)
是一种常见的溶剂,它可以通过以下方法制得:A(烃类)| Br2 |
| N2OH/水 |
| 浓H2SO4 |
| △脱水 |
| A、丁烯 | B、丁炔 | C、乙炔 | D、乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸碱中和反应能生成盐和水,所以生成盐和水的反应一定是中和反应 |
| B、饱和溶液降低温度一定会析出晶体 |
| C、组成元素相同的物质化学性质不一定相同 |
| D、质子数相同的两种粒子其核外电子数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合物:石炭酸、福尔马林、水玻璃、水银 |
| B、化合物:CaCl2、烧碱、聚苯乙烯、HD |
| C、同系物:CH2O2、C2H4O2、C3H4O2、C4H8O2 |
| D、同素异形体:C60、C70、金刚石、石墨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
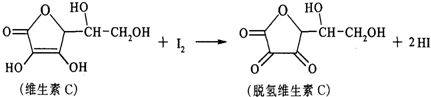
| A、上述反应为取代反应 |
| B、维生素C能抗衰老是因为有氧化性 |
| C、滴定时可用淀粉溶液作指示剂 |
| D、维生素C能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如图所示(某些产物已略去):
由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如图所示(某些产物已略去):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在平衡常数表达式中,反应物浓度用初始浓度,生成物浓度用平衡浓度 |
| B、在任何条件下,化学平衡常数是一个恒定值 |
| C、平衡常数的大小只与浓度有关,而与温度、压强、催化剂等无关 |
| D、从平衡常数的大小可以推断一个反应进行的程度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com