
分析 Ⅰ(1)在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,硝酸被还原为NO;生成的NO会污染空气,硝酸会腐蚀设备;
(2)①已知:Ⅰ.OHC-CHO(g)+2H2(g)?HOCH2CH2OH(g)△H=-78kJ•mol-1 K1
2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1 K2
根据盖斯定律,Ⅱ-Ⅰ可得:HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g),反应热也进行相应计算,平衡常数为反应Ⅱ与Ⅰ的平衡常数的商;
②主反应HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g)为放热反应,升高温度平衡逆向移动;温度超过495℃时,乙二醇大量转化为二氧化碳等副产物;
Ⅱ(3)A.可变的恒压密闭容器中反应,550℃时若充入惰性气体,相当于减小压强,则v正,v逆均减小,又该反应是气体体积增大的反应,则平衡正向移动;
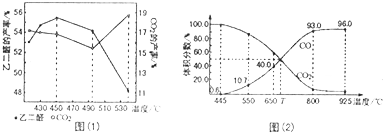
B.由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,根据三段式进行计算;
C.由图可知,T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态;
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=$\frac{{P(CO)}^{2}}{{P(C{O}_{2})}^{2}}$,据此计算.
解答 解:(1)在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,硝酸被还原为NO,反应方程式为:3CH3CHO+4HNO3$\stackrel{Cu(NO_{3})_{2}}{→}$3OHC-CHO+4NO↑+5H2O,存在比较明显的缺点是:生成的NO会污染空气,硝酸会腐蚀设备,
故答案为:3CH3CHO+4HNO3$\stackrel{Cu(NO_{3})_{2}}{→}$3OHC-CHO+4NO↑+5H2O;生成的NO会污染空气,硝酸会腐蚀设备;
(2)①已知:Ⅰ.OHC-CHO(g)+2H2(g)?HOCH2CH2OH(g)△H=-78kJ•mol-1 K1
Ⅱ.2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1 K2
根据盖斯定律,Ⅱ-Ⅰ可得:HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g),则△H=-484kJ•mol-1-(-78kJ•mol-1)=-406kJ•mol-1,平衡常数K反应Ⅱ与Ⅰ的平衡常数的商,即K=$\frac{{K}_{2}}{{K}_{1}}$,故答案为:-406;$\frac{{K}_{2}}{{K}_{1}}$;
②主反应HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g)为放热反应,升高温度平衡逆向移动;温度超过495℃时,乙二醇大量转化为二氧化碳等副产物,使乙二醛产率降低,
故答案为:升高温度,主反应平衡逆向移动;温度超过495℃时,乙二醇大量转化为二氧化碳等副产物;
Ⅱ(3)A.可变的恒压密闭容器中反应,550℃时若充入惰性气体,相当于减小压强,则v正,v逆均减小,又该反应是气体体积增大的反应,则平衡正向移动,故A错误;
B.由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,转化了xmol,
则有C(s)+CO2(g)?2CO(g)
开始 1 0
转化 x 2x
平衡 1-x 2x
所以$\frac{2x}{1-x+2x}$×100%=40%,解得x=0.25mol,则CO2的转化率为$\frac{0.25}{1}$×100%=25%,故B正确;
C.由图可知,T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态,所以平衡不移动,故C错误;
D.925℃时,CO的体积分数为96%,则CO2的体积分数都为4%,所以用平衡分压代替平衡浓度表示的化学平衡常数Kp=$\frac{{P(CO)}^{2}}{{P(C{O}_{2})}^{2}}$=$\frac{{(0.96P)}^{2}}{0.04P}$=23.0P,故D错误;
故选:B.
点评 本题考查化学平衡常数计算、运用盖斯定律计算反应热、新情境下的方程式的书写、化学平衡图象分析、阅读题目获取信息的能力等,难度中等,需要学生具备运用信息与基础知识分析问题、解决问题的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=5的NH4Cl溶液或醋酸溶液中,由水电离出的 c(H+)均为10-9mol•L-1 | |
| B. | 常温下,将pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| C. | 在c(H+):c(OH-)=1:l012的溶液中,Na+、I-、NO3-、SO42-能大量共存 | |
| D. | 0.1 mol•L-1 Na2CO3溶液和0.1 mol•L-1 NaHSO4溶液等体积混合,溶液中:c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷 | B. | 丙烷 | ||
| C. | 2-甲基丙烷(CH3)3CH | D. | 2,2-二甲基丙烷(CH3)4C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
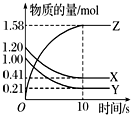 一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
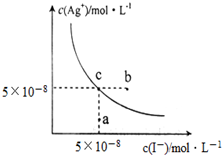 在t℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13.下列说法不正确的是( )
在t℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13.下列说法不正确的是( )| A. | 在t℃时,AgI的Ksp=2.5×10-15 mol2•L-2 | |
| B. | 图中b点有碘化银晶体析出 | |
| C. | 向c点溶液中加入适量蒸馏水,可使溶液由c点到a点 | |
| D. | 在t℃时,反应AgBr(s)+I-(aq)?AgI(s)+Br-(aq) 的平衡常数K=200 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-、OH-、Na+、H+ | B. | Al3+、Na+、Cl-、AlO2- | ||
| C. | Ba2+、HCO3-、K+、SO42- | D. | S2-、H+、SO42-、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
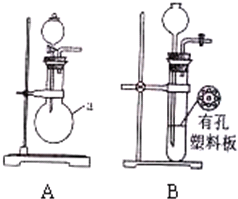 (1)用A装置制SO2,化学反应方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑.
(1)用A装置制SO2,化学反应方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com