
【题目】某研究性学习小组,用下列仪器、药品验证足量合金(由Cu、Fe、Zn三种物质组成)和适量浓硝酸反应产生的气体中含NO(N2和O2的用量可自由控制,气体液化温度:NO2:21℃,NO:-152℃)
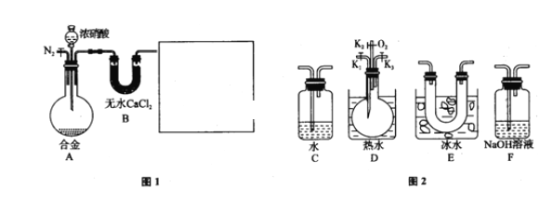
(1)在图2中选择恰当的仪器将图1补充完整,所选择仪器的连接顺序(按左→右连接,填各仪器编号)为_________.
(2)反应前先通入N2目的是_______________________________________.
(3)确认气体中含NO的现象是_____________________________________.
(4)本题中,浓硝酸(含溶质a mol)完全反应,还原产物只有NO和NO2,被还原硝酸的物质的量n的取值范围为_________________________________________。
【答案】EDF 排尽装置中的空气,防止NO被氧化 D中烧瓶内通入O2后,无色气体变成红棕色 a/4 mol< n < a/2 mol
【解析】
本题考查的是金属和浓硝酸的反应。
①涉及的方程式为![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]()
②验证足量合金(由Cu、Fe、Zn三种物质组成)和适量浓硝酸反应产生的气体中是否含NO反应前先通入N2排尽装置中的空气,防止NO被氧化,其次要排除NO2的干扰,可根据信息提示“NO2的液化温度为21℃,NO的液化温度为-152℃”将剩余气体通过E装置,NO2会液化,若含有NO,没有达到NO的液化温度,NO不会液化。再将剩余气体通过D装置,向D中烧瓶内通入O2后,若无色气体变成红棕色,则证明气体中含有NO。
(1)合金(由Cu、Fe、Zn三种物质组成)和适量浓硝酸反应产生的气体有NO2,随着反应的进行浓硝酸浓度越来越小逐渐变为稀硝酸,还可能会产生一部分NO,另外产生的气体中还会携带一部分水蒸气。首先将混合气体通过B装置,B装置中的无水氯化钙是干燥剂,可以除去水蒸气。由于NO2的液化温度为21℃,NO的液化温度为-152℃,将剩余气体通过E装置,NO2会液化,若含有NO,没有达到NO的液化温度,NO不会液化。再将剩余气体通过D装置,向D中烧瓶内通入O2后,若无色气体变成红棕色,则证明气体中含有NO。NO2和NO任意排放会污染空气,最终气体应通入到F中用氢氧化钠吸收。通过分析可知图1中缺少仪器的连接顺序为EDF。本小题答案为:EDF。
(2)反应前先通入N2目的是排尽装置中的空气,防止NO被氧化。本小题答案为:排尽装置中的空气,防止NO被氧化。
(3)由(1)中分析可知确认气体中含NO的现象是向D中烧瓶内通入O2后,无色气体变成红棕色。本小题答案为:D中烧瓶内通入O2后,无色气体变成红棕色。
(4)合金中的金属和浓硝酸反应,若生成的气体全部是NO2,则有1/2的浓硝酸被还原,即有a/2 mol的浓硝酸被还原;若生成的气体全部是NO,则有1/4的浓硝酸被还原,即有a/4 mol的浓硝酸被还原。因为生成的气体只有NO和NO2,所以被还原硝酸的物质的量n的取值范围为a/4 mol< n < a/2 mol。


科目:高中化学 来源: 题型:
【题目】一定温度下,向如图所示带有可移动活塞的密闭容器中充入2 L SO2 和1 L O2 的混合气体,发生如下反应2 SO2 (g) + O2 (g) ![]() 2 SO3 (g) 。
2 SO3 (g) 。

(1)若活塞可自由移动,平衡后,活塞停止在“2.1”处,则该反应中SO2 的转化率为_______。
(2)若使活塞固定在“3”处,向容器中充入4L SO2和2L O2,反应进行到某一时刻时, SO2和O2的转化率之比为 _____
(3)若使活塞固定在“3”处的三个相同容器,开始时,充入容器的起始物质分别是①2L SO2和1L O2 ;②2 L SO3 (g) 和 1 L N2 ;③1 L SO2 、1 L O2 和 1 L SO3 (g)。上述三种投料方式的反应体系均达到平衡后,则三种情况容器中SO3 (g)的物质的量浓度大小关系是__________(用序号和“<”、“=”、“>”表示)。
(4)向(1)平衡后的容器中充入0.2 mol 的SO3,活塞移动后再次达到平衡时,测得此过程中从外界共吸收了1.96 kJ 的热量。写出SO2 发生氧化反应的热化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于水的说法正确的是
A.我们平时应多饮用纯净水,防止有毒物质进入体内
B.所有天然水都可以直接饮用
C.含有较多钙、镁离子的水叫硬水
D.人体内含水量约占体重的2/3,故人每天不用喝水也可以
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把A、B、C、D四块金属片浸入稀硫酸中,分别用导线两两相连可以组成原电池。A、B相连时A为负极;C、D相连时,电流由D→C;A、C相连时,C极上产生大量气泡,B、D相连时,D极发生氧化反应。这四种金属的活动性顺序是
A.A>B>C>DB.A>C>D>BC.C>A>B>DD.B>D>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素性质呈周期性变化的决定因素是( )
A.元素原子半径大小呈周期性变化
B.元素相对原子质量依次递增
C.元素原子最外层电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化(O、F除外)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“长征二号”系列火箭用的燃料是液态的偏二甲肼(C2H8N2),氧化剂是液态的N2O4,已知已知1.5g偏二甲基肼完全燃烧生成N2、CO2和液态H2O放出热量50kJ热量。下列说法不正确的是
A. 燃料在火箭发动机中燃烧是将化学能主要转变为热能和机械能
B. 液态N2O4气化时共价键没被破坏
C. 依题可知C2H8N2的燃烧热为50kJ/mol
D. 偏二甲基肼在N2O4中燃烧时的化学方程式为:C2H8N2+2N2O4![]() 2CO2+3N2+4H2O
2CO2+3N2+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如下装置![]() 略去部分夹持仪器
略去部分夹持仪器![]() 制取
制取![]() 并验证其性质.
并验证其性质.
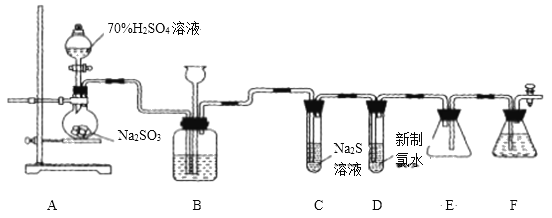
(1)盛装![]() 的仪器名称为__________
的仪器名称为__________ ![]() ,还缺少的玻璃仪器是________,用
,还缺少的玻璃仪器是________,用![]() 的化学方程式_______.
的化学方程式_______.
(2)装置B的作用之一是通过观察产生气泡的多少判断![]() 生成的快慢,其中的液体最好选择____
生成的快慢,其中的液体最好选择____![]() 填代号
填代号![]() .
.
a. 饱和![]() 溶液 b. 饱和
溶液 b. 饱和![]() 溶液
溶液
c. 饱和![]() 溶液 d. 饱和NaHSO3溶液
溶液 d. 饱和NaHSO3溶液
(3)验证二氧化硫的氧化性的装置是______,现象为_______________.
(4)为验证二氧化硫的还原性,充分反应后,取该试管中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入![]() 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入![]() 溶液,产生白色沉淀.
溶液,产生白色沉淀.
上述方案合理的是方案________![]() 填“I”、“Ⅱ”或“Ⅲ”
填“I”、“Ⅱ”或“Ⅲ”![]() ;若将试管D中新制氯水改为酸性高锰酸钾溶液,则发生反应的离子方程式为____________________.
;若将试管D中新制氯水改为酸性高锰酸钾溶液,则发生反应的离子方程式为____________________.
(5)装置F的作用是___________________![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)===CO2(g)+3H2(g)。下图是该反应的能量变化图:

①通过图中信息可判断反应CH3OH(g)+H2O(g)===CO2(g)+3H2(g)的ΔH________0(选填“>”“=”或“<”)。
②图中途径(Ⅱ)的条件是__________________,途径(Ⅰ)的反应热________途径(Ⅱ)的反应热(选填“>”“=”或“<”)。
③在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为__________________________________________。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)===H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com