
【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A. 图Ⅰ所示电池中,锌为负极,MnO2的作用是催化剂
B. 图II所示电池二氧化铅为正极,放电过程中硫酸浓度不变
C. 图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图IV所示电池工作过程中,Ag2O是氧化剂
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】氮的氧化物(如NO2、N2O4、N2O5等)应用很广,在一定条件下可以相互转化。
(1)已知:N2O5在一定条件下发生分解2N2O5(g) ![]() 4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
T/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/mol·L-1 | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为p0,第2.00 min时体系压强为p,则p∶p0=________;1.00~3.00 min内,O2的平均反应速率为________。
(2)在N2O4与NO2之间存在反应:N2O4(g)![]() 2NO2(g)。将1 mol的N2O4放入1 L的恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g)。将1 mol的N2O4放入1 L的恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
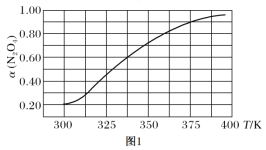
①337.5 K时,反应的平衡常数K=________(填写计算结果)。
②据图推测N2O4(g) ![]() 2NO2(g)是吸热反应,理由是_______________。
2NO2(g)是吸热反应,理由是_______________。
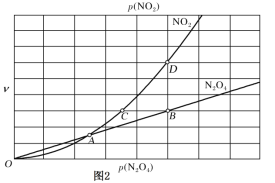
③对于反应N2O4(g)![]() 2NO2(g),用平衡时各组分压强关系表达的平衡常数
2NO2(g),用平衡时各组分压强关系表达的平衡常数![]() 。在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2· [p(NO2)]2。其中,k1、k2是与反应及温度有关的常数。相应的速率—压强关系如图所示:一定温度下,k1、k2与平衡常数Kp的关系是k1=________,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由___。
。在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2· [p(NO2)]2。其中,k1、k2是与反应及温度有关的常数。相应的速率—压强关系如图所示:一定温度下,k1、k2与平衡常数Kp的关系是k1=________,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法正确的是

A. O2所在的铂电极处发生氧化反应
B. H+透过质子交换膜流向呼气所在的铂电极
C. 电路中流过2mol电子时,消耗标准状况下11.2LO2
D. 该电池的负极反应式为:CH3CH2OH+3H2O-12e-=2CO2+12H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(![]() ),其原理如下图所示,下列说法正确的是
),其原理如下图所示,下列说法正确的是

A.该装置为电解装置,B为阳极
B.A极的电极反应式为 ![]() + e- = Cl- +
+ e- = Cl- + ![]()
C.当外电路中有0.1 mol e-转移时,A极区增加的H+的个数为0.1 NA
D.电子从B极沿导线经小灯泡流向A极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用以下各装置连接成一整套装置,探究氯气与氨气之间的反应。其中D为纯净干燥的氯气与纯净干燥氨气反应的装置。

请回答下列问题:
(1)连接好装置后,必需进行的一步实验操作是_____________。
(2)装置E的作用是___,橡胶管k的作用是___________________。
(3)从装置D的G处逸出的尾气中可能含有黄绿色的有毒气体,处理方法是_________。
(4)装置F中试管内发生反应的化学方程式_______________。
(5)接入D装置的两根导管左边较长、右边较短,目的是__________.
(6)整套装置从左向右的连接顺序是(j)接(___)(___)接(f)(g)接(___)(___)接(___)(___)接(a)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如下图所示:
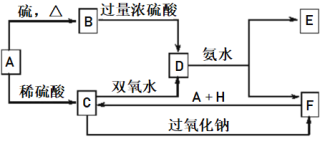
已知A是一种单质,将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)写出C的溶液与双氧水反应的离子方程式:_________________。
(2)写出鉴定E中阳离子的实验方法和现象:________________。
(3)F是一种难溶物质,其溶度积常数为1.0×10-39。向D溶液中加碱调节至pH为_______时,铁离子刚好沉淀完全(离子浓度小于1.0×10-5 mol·L-1时,即可认为该离子沉淀完全)。
(4)已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= –99 kJ·mol-1,单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 molSO3(g)的△H=__________kJ·mol-1。
(5)在200 mL 1.5 mol·L-1 NaOH溶液中通入标准状况下4.48L CO2气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,请写出工业合成氨的化学反应方程式_____。
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是______。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。

请回答:
①写出甲中发生反应的离子方程式______。
②乙装置中的试剂是______。
③实验结束后,分离出NaHCO3晶体的操作是______(填分离操作的名称)。
(4)第二位同学:用图中戊装置进行实验(其它装置未画出)。
①为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入______气体,再从b管中通入______气体。
②装置c中的试剂为______(选填字母)。
e.碱石灰 f.浓硫酸 g.无水氯化钙
③若该同学进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用电子式表示H2O和MgBr2的形成过程:___、___。
(2)H2O以___键结合,MgBr2以___键结合。(填极性键、非极性键、离子键)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com