
| A. | H2SO4 | B. | CuSO4 | C. | NaCl | D. | KOH |
分析 电解时,阳离子氧化性越强,越易放电,阳离子放电顺序为Ag+>Hg2+>Fe3+>Cu2+>H+(H+浓度较大时)>Pb2+>Sn2+>Fe2+>Zn2+>H+(H+浓度较小时)>Al3+>Mg2+>Na+>Ca2+>K+,阴离子还原性越强,越易放电,阴离子放电顺序为S2->I->Br->Cl->OH->含氧酸根离子>F-,以此解答该题.
解答 解:题中涉及阳离子放电顺序为Cu2+>H+>Na+>>K+,阴离子放电顺序为Cl->OH->SO42-,用惰性电极电解下列溶液时在阴极有固体析出,在阳极有气泡产生,只有符合CuSO4,发生2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,
故选B.
点评 本题考查电解原理,为高频考点,侧重于学生的分析能力的考查,注意把握离子的放电顺序,为解答该题的关键,难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z | |
| B. | 非金属性:X>Y>Z | |
| C. | 阴离子的还原性按X、Y、Z的顺序由强到弱 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序由弱到强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由不同种元素原子形成的共价键 | |
| B. | 由同种元素的两个原子形成的共价键 | |
| C. | 分子中必定含有极性键 | |
| D. | 共同电子对必然偏向吸引电子能力强的原子一方 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
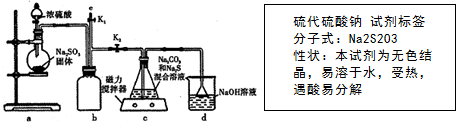
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
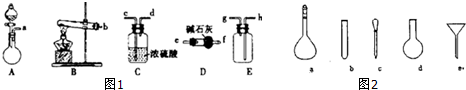
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com