
【题目】下列气体中,既可用浓硫酸干燥,又可用NaOH固体干燥的是
A.Cl2B.NH3C.SO2D.O2
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-181.6 kJ·mol-1;
CH3OH(g)+H2O(g) ΔH1=-181.6 kJ·mol-1;
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1。
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式:________________________________________________________________________。
(2)在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率v(CH3OCH3)=______________________________;KA、KB、KC三者之间的大小关系为______________________________。
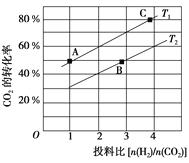
(3)若2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1在恒温恒压下进行,以下叙述能说明该反应达到平衡状态的是________(填序号)。
CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1在恒温恒压下进行,以下叙述能说明该反应达到平衡状态的是________(填序号)。
A.CO和H2的物质的量浓度之比是1∶2
B.CO的消耗速率等于CH3OCH3的生成速率的2倍
C.容器中混合气体的体积保持不变
D.容器中混合气体的平均摩尔质量保持不变
E.容器中混合气体的密度保持不变
(4)如图P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1 mol CH3OH(g)和2 mol H2O(g),向B容器中充入1.2 mol CH3OH(g)和2.4 mol H2O(g),两容器分别发生反应CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)。已知起始时容器A和B的体积均为a L,反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH转化率为________;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
CO2(g)+3H2(g)。已知起始时容器A和B的体积均为a L,反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH转化率为________;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
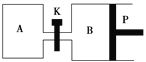
(5)CO2溶于水形成H2CO3。已知常温下H2CO3的电离平衡常数为K1=4.4×10-7、K2=4.7×10-11,NH3·H2O的电离平衡常数为K=1.75×10-5。常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显________(填“酸性”“中性”或“碱性”);请计算反应NH+HCO+H2O![]() NH3·H2O+H2CO3的平衡常数K=________________________________________________________________________。
NH3·H2O+H2CO3的平衡常数K=________________________________________________________________________。
(6)工业上采用电化学还原CO2是一种使CO2资源化利用的方法,如图是利用此法制备ZnC2O4的示意图(电解液不参与反应),下列说法正确的是____________。
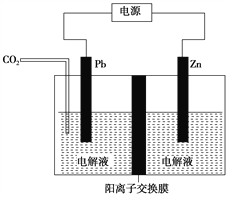
A.Zn与电源的负极相连
B.ZnC2O4在交换膜右侧生成
C.电解的总反应式为2CO2+Zn![]() ZnC2O4
ZnC2O4
D.通入11.2 L CO2,转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的钙离子、镁离子、硫酸根离子及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
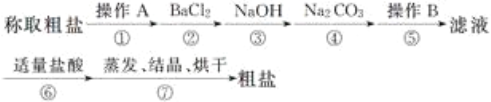
(1)第①步中,操作A是__________,第⑤步中,操作B是__________。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为氯化钙)____________________________。
(3)若先用盐酸调溶液至中性,再过滤,将对实验结果产生影响,其原因是_________________________。
(4)判断氯化钡已过量的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molCH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101kPa,120℃),其总质量为72g,下列有关叙述不正确的是
A. 若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收
B. 产物的平均摩尔质量为24g/mol
C. 若将产物通过浓硫酸充分吸收后恢复至(101kPa,120℃),则压强变为原来的1/3
D. 反应中消耗的氧气为56g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1盐酸分别滴定20.00 mL浓度均为0.10 mol·L-1 CH3COONa溶液和NaCN溶液,所得滴定曲线如右图(忽略体积变化)。下列说法正确的是

A. 溶液中阳离子的物质的量浓度之和:点②等于点③
B. 点①所示溶液中:c(CN—)+ c(HCN)=2c(Cl—)
C. 点②所示溶液中:c(Na+)> c(Cl-)> c(CH3COO-)> c(CH3COOH)
D. 点④所示溶液中:c(Na+)+ c(CH3COOH)+ c(H+)>0.10 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰的综合利既有利于节约资源又有利于保护环境。某粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)的铝、铁分离工艺流程如下:
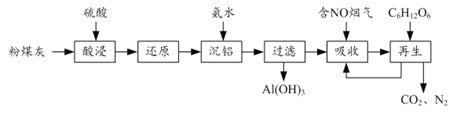
(1)①“酸浸”时Al2O3发生反应的离子方程式为______。
②当硫酸质量分数大于50%,金属氧化物浸出率明显下降。其原因是______。
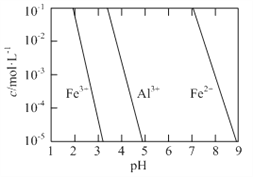
(2)有关金属离子以氢氧化物沉淀时离子浓度随pH变化如图所示。若浸出液不经还原直接与氨水混合,铝、铁元素分离效果较差的原因是______。
(3)沉铝后所得FeSO4溶液可用于烟气中NO吸收,其原理为Fe2++2NO![]() [Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
[Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
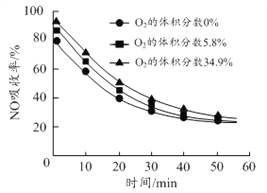
①为提高烟气中NO 的吸收率,可采取的措施有______(答一条,并说明理由)。
②“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6发生反应的离子方程式为______。
(4)Al(OH)3经过一系列反应可获得粗铝,利用熔融状态下物质密度不同,通过三层液电解精炼法可由粗铝获得高纯铝(装置如图所示)。

①该装置工作时,电极A作______极。
②熔融粗铝时加入铜的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质或应用正确的是( )
A.钠与硫酸铜溶液反应会置换出红色的铜
B.常温下干燥氯气与铁不反应,可以用钢瓶储存液氯
C.SO2具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色
D.普通玻璃的组成可用Na2OCaO6SiO2表示,是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带和海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下:
![]()
某化学兴趣小组将上述流程②、③设计成如下图所示操作。
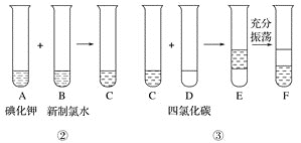
已知过程②发生反应的化学方程式为Cl2+2KI=2KCl+I2
回答下列问题:
(1)写出提取过程①、③中实验操作的名称:①____________,③____________。
(2)在灼烧过程中,使用到的实验仪器有酒精灯、泥三角、三脚架、玻璃棒、____________、____________。
(3)F中下层液体的颜色为________色,上层液体中溶质的主要成分为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取 CH3CH2Cl 最好的方法是( )
A.乙烷与氯气发生取代反应B.乙烯与氯气发生加成反应
C.乙烷与 HCl 发生取代反应D.乙烯与 HCl 发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com