
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与FeCl3溶液 ⑤Cl2和NaOH溶液 ⑥Fe和HNO3溶液 ⑦Fe和H2SO4溶液 ⑧Na和O2
(1)由于浓度不同而发生不同氧化还原反应的是_____________________________________。
(2)由于温度不同而发生不同氧化还原反应的是______________________________。
(3)氧化还原反应不受浓度、温度影响的是__________。
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
常温下0.1 mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
A.将溶液稀释到原体积的10倍
B.加入适量的醋酸钠固体
C.加入等体积0.2 mol·L-1盐酸
D.提高溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关除杂的实验操作合理的是 ( )。
A.除去二氧化碳中混有的少量一氧化碳:通入适量氧气后点燃
B.除去氧气中少量氮气:使气体通过炽热的铜粉
C.除去石英中少量碳酸钙:用稀盐酸溶解后过滤
D.除去氯化钠固体中少量的纯碱:加入足量氯化钙,过滤、蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
正误判断,正确的划“√”,错误的划“×”
(1)有单质参加或有单质生成的化学反应一定是氧化还原反应( )
(2)金属阳离子一定只具有氧化性( )
(3)氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原( )
(4)氧化还原反应中的反应物,不是氧化剂就是还原剂( )
(5)某元素从游离态变为化合态,该元素可能被氧化也可能被还原( )
查看答案和解析>>
科目:高中化学 来源: 题型:
正误判断,正确的划“√”,错误的划“×”
(1)强氧化剂与强还原剂混合不一定能发生氧化还原反应( )
(2)阳离子只有氧化性,阴离子只有还原性( )
(3)元素的非金属性越强,其氧化性越强,相应单质越活泼( )
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断正确的是( )
A.因为Fe3+具有氧化性,所以用KSCN溶液可以鉴别Fe3+(2013·广东理综,10B)
B.工业上利用合成氨实现人工固氮不涉及氧化还原反应(2012·广东理综,10C)
C.Na2O2用作呼吸面具的供氧剂不涉及氧化还原反应(2012·广东理综,10A)
D.实验室用NH4Cl和Ca(OH)2制备NH3不涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钠(Na2FeO4)是一种新型、高效、多功能的水处理剂。湿法制备的离子反应方程式:2Fe(OH)3+3ClO-+4OH-===2FeO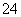 +3Cl-+5H2O;干法制备化学反应方程式:2FeSO4+4Na2O2===2Na2FeO4+2Na2SO4。有关分析错误的是( )
+3Cl-+5H2O;干法制备化学反应方程式:2FeSO4+4Na2O2===2Na2FeO4+2Na2SO4。有关分析错误的是( )
A.等物质的量Na2FeO4氧化能力优于次氯酸钠
B.湿法中氢氧化铁被氧化
C.干法中每生成1 mol Na2FeO4转移3 mol电子
D.次氯酸钠的氧化性大于高铁酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚氯酸钠和稀盐酸为原料制备ClO2,反应如下:
NaClO2+HCl—→ClO2↑+________(没有配平)
(1)上述方程式中,缺项物质是________,配平方程式,并在下面补全反应物系数。
 NaClO2+
NaClO2+ HCl—→
HCl—→
(2)该反应中氧化剂和还原剂的物质的量之比是________________________。
生成0.2 mol ClO2转移电子的物质的量为________ mol。
(3)ClO2对污水中的Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某污水中含CN- a mg·L-1,现用ClO2将CN-氧化,只生成两种无毒气体。处理100 m3这种污水,至少需要ClO2________ mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com