
【题目】相对分子质量为72的烷烃分子式是_____,它可能的结构简式有_____、_____、_____。
科目:高中化学 来源: 题型:
【题目】人们发现金星大气层有一种称之为羰基硫(COS)的分子,其结构与CO2类似,羰基硫是一种与生命密切相关的物质,下列推测不正确的是( )
A. COS是含有极性键的共价化合物B. COS的沸点比CO2高
C. COS 电子式为![]() D. COS中所有原子满足8电子稳定结构
D. COS中所有原子满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是

A. 图甲中(1)、(2)两个实验中H2O2分解的△H相同
B. 图乙实验可通过测定相同状况下,产生的气体体积与反应时间来比较反应速率
C. 图甲实验可通过观察产生气泡的快慢来比较反应速率
D. 图乙中,测定反应速率的装置可将分液漏斗用长颈漏斗替代 ,其测定结果相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3A(g)+B(g)![]() 2C(g)+2D(s)在2 L密闭容器中进行,经过4min,B减少了0.4 mol,则0~4min内此反应的平均速率为
2C(g)+2D(s)在2 L密闭容器中进行,经过4min,B减少了0.4 mol,则0~4min内此反应的平均速率为
A. v(A)=0.15 mol·L1B. v(B)=0.05 mol·L1·s1
C. v(C)=0.10 mol·L1·min1D. v(D)=0.10 mol·L1·min1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质分类和实验探究都是中学化学重要的学科思想。
(一)以下是对“一些物质与水反应”的分类图,请按要求填空:

上述分类方法是______;A组物质中属于电解质的是_____(填化学式);C组物质与水反应的离子方程式为_____;D组物质与水反应中,氧化剂和还原剂物质的量之比为1∶2的物质是___(填化学式)。
(二)用质量分数为98%的浓硫酸(密度为1.84 g·cm3)配制240 mL浓度为0.5 mol·L-1的硫酸溶液,选用到的仪器正确的是______(填序号)。

下列操作会使配制结果偏高的是_______(填序号)
A 容量瓶用蒸馏水洗净后,未进行干燥处理
B 稀释的硫酸转移到容量瓶中后未洗涤烧杯
C 未冷却,即将溶液注入容量瓶并定容
D定容时,俯视容量瓶的刻度线
(三)某小组用如下装置比较氯、溴、碘的非金属性强弱实验(夹持仪器已略去,气密性已检验)。

实验步骤:
①打开弹簧夹,打开活塞a,滴加浓盐酸;
②当B和C中的溶液都变为黄色时,夹紧弹簧夹;
③当B中溶液由黄色变为棕红色时,关闭活塞a;
④打开活塞b,将少量C中溶液滴入试管D中,关闭活塞b,取下试管D振荡,静置后CCl4层变为紫红色。
请回答:
(1)装置A中证明氯的非金属性强于碘的实验现象是_________。
(2)B中溶液发生反应的离子方程式是_______________。
(3)步骤③实验的目的是确认C的黄色溶液中无_____(填化学式)。步骤④能否说明非金属性:Br>I_______(填“能”或“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,由CO2与H2反应可合成甲醇,反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);如图所示为向一固定容积为2 L的绝热密闭容器中加入1 mol CH3OH和1 mol H2O后,反应体系内CO2浓度的变化;其中第5 min 时,在其他条件不变的条件下,向容器中加入一定物质的量的 CO2和H2,第8 min 重新达到平衡状态,此时反应体系内c(H2)=c(CH3OH)。下列说法错误的是
CH3OH(g)+H2O(g);如图所示为向一固定容积为2 L的绝热密闭容器中加入1 mol CH3OH和1 mol H2O后,反应体系内CO2浓度的变化;其中第5 min 时,在其他条件不变的条件下,向容器中加入一定物质的量的 CO2和H2,第8 min 重新达到平衡状态,此时反应体系内c(H2)=c(CH3OH)。下列说法错误的是

A. 0~4 min 内,生成CO2的平均反应速率为0.025 mol·L-1·min-1
B. 第5 min 时在反应容器中加入了0.20 mol CO2和0.40 mol H2
C. 8 min后CH3OH的平衡浓度为0.425 mol·L-1
D. 前5 min CH3OH的转化率为20%,5~8 min H2的转化率为37.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,可逆反应A(g)+B(g)![]() xC(g),有下图所示的关系曲线,根据下图下列判断正确的是
xC(g),有下图所示的关系曲线,根据下图下列判断正确的是

A.p3>p4,y轴表示A的转化率
B.p3>p4,y轴表示混合气体的密度
C.p3<p4,y轴表示B的质量分数
D.p3<p4,y轴表示混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H—H | C—O | C←=O | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
已知ΔH2=-58 kJ·mol-1,由此计算ΔH3=________kJ·mol-1。
(2)图1中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是___________________________________________________。
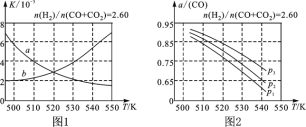
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而________(填“增大”或“减小”),其原因是______________________________________________________。图2中的压强由大到小为__________,其判断理由是___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com