

分析 (1)根据含25%NaClO、1000mL、密度1.19g•cm-3,结合c=$\frac{1000ρω}{M}$来计算;
(2)根据稀释前后溶质的物质的量不变来计算;
(3)根据溶液的配制及c=$\frac{n}{V}$、m=nM来分析;
(4)根据c=$\frac{n}{V}$,分析操作对溶质的物质的量或对溶液的体积的影响判断;
(5)①根据c(H2SO4)=$\frac{1}{2}$c(H+)计算;
②根据溶液稀释前后溶质的物质的量不变计算
解答 解:(1)c(NaClO)=c=$\frac{1000ρω}{M}$=$\frac{1000×1.19×25%}{74.5}$=4.0 mol•L-1,故答案为:4.0;
(2)稀释后c(NaClO)=$\frac{1}{100}$×4.0 mol•L-1=0.04 mol•L-1,c(Na+)=c(NaClO)=0.04 mol•L-1,故答案为:0.04;
(3)A.需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A、B、不需要,但还需玻璃棒和胶头滴管,故A错误;
B.配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,故B错误;
C.由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏低,故C正确;
D.应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×4.0 mol•L-1×74.5 g•mol-1=149 g,故D错误;
故答案为:C.
(4)Ⅰ.定容时俯视刻度线,导致溶液体积偏小,浓度偏大,故答案为:A;
Ⅱ.未冷至室温就转移定容,冷却后体积偏小,则浓度偏大,故答案为:A;
Ⅲ.转移前,容量瓶内有蒸馏水,对实验结果没有影响,故答案为:C;
Ⅳ.定容时水多用胶头滴管吸出,溶液体积偏大,浓度偏低,故答案为:B.
(5)①c(H2SO4)=2.3mol•L-1,则c(H+)=4.6mol•L-1,故答案为:4.6;
②溶液稀释前后溶质的物质的量不变,浓硫酸的浓度为c=$\frac{1000×1.84×98%}{98}$=18.4mol/L,假设需要浓硫酸的体积为V,
则V×18.4mol/L=2L×2.3mol/L,V=0.25L=250mL,
故答案为:250.
点评 本题考查物质的量浓度的计算以及溶液的配制,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握相关计算公式的运用,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) | B. | H2O+H2O=H3O++OH- | ||
| C. | NH3.H2O(aq)=NH3(g)+H2O(1) | D. | Cl2+H2O=H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与稀硫酸的反应:OH-+H+=H2O | |
| B. | 澄清的石灰水与稀醋酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 在Ca(HCO3)2溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 往澄清石灰水通入过量二氧化碳气体:CO2+OH-=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的沸点比
的沸点比 高,原因
高,原因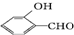 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用100 mL 容量瓶配制所需的95 mL 0.1 mol•L-1 NaOH溶液 | |
| B. | 用50mL烧杯准确量取30.5 mL NaOH溶液 | |
| C. | 用托盘天平称取25.30gNaCl | |
| D. | 用50 mL 量筒量取4.8 mL浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑧ | B. | ①③④⑤⑧ | C. | ①③④⑧ | D. | 以上均不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si和Al | B. | N和P | C. | F和Cl | D. | C和Al |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com