
| A£® | ·ÖŅŗ”¢ÕōĮ󔢹żĀĖŗĶ½į¾§µČ¶¼ŹĒ»ģŗĻĢåĻµ·ÖĄėĢį“æ³£ÓƵķ½·Ø | |
| B£® | ¼ģŃéŗģש֊µÄŗģÉ«ĪļÖŹŹĒ·ńŹĒFe2O3µÄ²Ł×÷²½ÖčĪŖ£ŗѳʷ”ś·ŪĖ锜¼ÓĖ®Čܽā”ś¹żĀĖ”śĻņĀĖŅŗÖŠµĪ¼ÓKSCNČÜŅŗ | |
| C£® | ŅŌĻĀĮłÖÖĪŽÉ«ČÜŅŗ£ŗŅ½ÓĆ¾Ę¾«”¢ø£¶ūĀķĮÖ”¢ŅĻĖįČÜŅŗ”¢ŅŅĖįČÜŅŗ”¢ĘĻĢŃĢĒČÜŅŗ”¢Ļ”ĮņĖį£¬ÓĆŠĀÖĘCu£ØOH£©2Šü×ĒŅŗ¼°¼ņµ„µÄŹµŃé²Ł×÷¼“æÉŅ»Ņ»¼ų±š | |
| D£® | µķ·ŪÓė20%µÄĮņĖį»ģŗĻČÜŅŗŌŚ·ŠĖ®Ō”ÖŠ³ä·Ö¼ÓČČŗó£¬ĄäČ“ŗóµĪ¼ÓŠĀÖĘCu£ØOH£©2×ĒŅŗ£¬¼ÓČČ£¬ĪŽ×©ŗģÉ«³Įµķ³öĻÖ£¬ĖµĆ÷µķ·ŪĪ“Ė®½ā |
·ÖĪö A£®·ÖŅŗ·ÖĄė»„²»ĻąČܵÄŅŗĢ唢ÕōĮó·ÖĄė»„Čܵ«·Šµć²»Ķ¬µÄŅŗĢ唢¹żĀĖ·ÖĄė²»ČÜŠŌ¹ĢĢåÓėŅŗĢ唢½į¾§·ÖĄėæÉČÜŠŌ¹ĢĢåÓėŅŗĢ壻
B£®Fe2O3²»ČÜÓŚĖ®£¬æÉČÜÓŚŃĪĖį£»
C£®ø£¶ūĀķĮÖ”¢ŅĻĖįČÜŅŗ”¢ĘĻĢŃĢĒČÜŅŗ¾łÓėÖĘCu£ØOH£©2Šü×ĒŅŗ·“Ӧɜ³ÉשŗģÉ«³Įµķ£»
D£®Ė®½āÉś³ÉĘĻĢŃĢĒ£¬¼ģŃéĘĻĢŃĢĒÓ¦ŌŚ¼īŠŌČÜŅŗÖŠ£®
½ā“š ½ā£ŗA£®·ÖŅŗ·ÖĄė»„²»ĻąČܵÄŅŗĢ唢ÕōĮó·ÖĄė»„Čܵ«·Šµć²»Ķ¬µÄŅŗĢ唢¹żĀĖ·ÖĄė²»ČÜŠŌ¹ĢĢåÓėŅŗĢ唢½į¾§·ÖĄėæÉČÜŠŌ¹ĢĢåÓėŅŗĢ壬Ōņ·ÖŅŗ”¢ÕōĮ󔢹żĀĖŗĶ½į¾§µČ¶¼ŹĒ»ģŗĻĢåĻµ·ÖĄėĢį“æ³£ÓƵķ½·Ø£¬¹ŹAÕżČ·£»
B£®Fe2O3²»ČÜÓŚĖ®£¬æÉČÜÓŚŃĪĖį£¬Ōņ¼ģŃéŗģש֊µÄŗģÉ«ĪļÖŹŹĒ·ńŹĒFe2O3µÄ²Ł×÷²½ÖčĪŖ£ŗѳʷ”ś·ŪĖ锜¼ÓŃĪĖįČܽā”ś¹żĀĖ”śĻņĀĖŅŗÖŠµĪ¼ÓKSCNČÜŅŗ£¬¹ŹB“ķĪó£»
C£®ø£¶ūĀķĮÖ”¢ŅĻĖįČÜŅŗ”¢ĘĻĢŃĢĒČÜŅŗ¾łÓėÖĘCu£ØOH£©2Šü×ĒŅŗ·“Ӧɜ³ÉשŗģÉ«³Įµķ£¬ŌņÖ»ĄūÓĆŠĀÖĘCu£ØOH£©2Šü×ĒŅŗ²»Äܼų±š£¬¹ŹC“ķĪó£»
D£®Ė®½āÉś³ÉĘĻĢŃĢĒ£¬¼ģŃéĘĻĢŃĢĒÓ¦ŌŚ¼īŠŌČÜŅŗÖŠ£¬ŌņĖ®½āŗóÓ¦¼Ó¼īÖĮ¼īŠŌ£¬ŌŁµĪ¼ÓŠĀÖĘCu£ØOH£©2×ĒŅŗ£¬¼ÓČČ£¬ĪŽ×©ŗģÉ«³Įµķ³öĻÖ£¬ĖµĆ÷µķ·ŪĪ“Ė®½ā£¬¹ŹD“ķĪó£»
¹ŹŃ”A£®
µćĘĄ ±¾Ģāæ¼²é»ÆѧŹµŃé·½°øµÄĘĄ¼Ū£¬ĪŖøßĘµæ¼µć£¬Éę¼°»ģŗĻĪļ·ÖĄėĢį“攢ĪļÖŹ¼ų±šŗĶ¼ģŃ锢ӊ»śĪļ½į¹¹ÓėŠŌÖŹµČ£¬°ŃĪÕĪļÖŹµÄŠŌÖŹ”¢ŹµŃé¼¼ÄÜĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėŹµŃéÄÜĮ¦µÄ漲飬עŅāŹµŃéĘĄ¼ŪŠŌ·ÖĪö£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼ÓĖ®Ļ”ŹĶ0.1mol•L-1 CH3COOHČÜŅŗŹ±£¬ČÜŅŗÖŠĖłÓŠĄė×ÓÅØ¶Č¾ł¼õŠ” | |
| B£® | ¶ŌFeCl3ČÜŅŗ½ųŠŠĻ”ŹĶŹ±£¬Fe3+µÄĖ®½ā³Ģ¶ČŌö“󣬹ŹČÜŅŗµÄĖįŠŌŌöĒæ | |
| C£® | æÉøł¾ŻÄŃČܵē½āÖŹKspµÄŹżÖµ“óŠ”Ö±½Ó±Č½ĻÄŃČܵē½āÖŹŌŚĖ®ÖŠµÄČܽā¶Č“óŠ” | |
| D£® | 25”ꏱ£¬Ksp£ØAgCl£©£¾Ksp£ØAgI£©£¬ĻņAgClŠü×ĒŅŗÖŠ¼ÓČėKI¹ĢĢ壬ӊ»ĘÉ«³ĮµķÉś³É |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.023mol/L | B£® | 0.045mol/L | C£® | 0.45mol/L | D£® | ĪŽ·Ø¼ĘĖć |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĢśÓėH2SO4·“Ó¦£ŗFe+2H+=Fe3++H2”ü | |
| B£® | Ģ¼ĖįÄĘČÜŅŗÖŠ¼ÓČė³ĪĒåŹÆ»ŅĖ®£ŗCa£ØOH£©2+CO32-=CaCO3”ż+2OH- | |
| C£® | ĒāŃõ»Æ±µČÜŅŗÓėĻ”H2SO4 ·“Ó¦£ŗBa2++OH-+H++SO42-=BaSO4”ż+H2O | |
| D£® | NaHCO3ČÜÓŚĻ”ŃĪĖįÖŠ£ŗHCO3-+H+=CO2”ü+H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
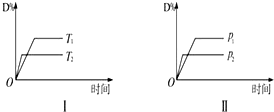 ¶ŌÓŚæÉÄę·“Ó¦mA£Øg£©+nB£Øs£©?pC£Øg£©+qD£Øg£©·“Ó¦¹ż³ĢÖŠ£¬ĘäĖūĢõ¼ž²»±äŹ±£¬DµÄ°Ł·Öŗ¬ĮæÓėĪĀ¶Č£ØT£©»ņŃ¹Ēæ£ØP£©¹ŲĻµČēĶ¼ĖłŹ¾£¬·“Ó¦“ļĘ½ŗāŗó£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø””””£©
¶ŌÓŚæÉÄę·“Ó¦mA£Øg£©+nB£Øs£©?pC£Øg£©+qD£Øg£©·“Ó¦¹ż³ĢÖŠ£¬ĘäĖūĢõ¼ž²»±äŹ±£¬DµÄ°Ł·Öŗ¬ĮæÓėĪĀ¶Č£ØT£©»ņŃ¹Ēæ£ØP£©¹ŲĻµČēĶ¼ĖłŹ¾£¬·“Ó¦“ļĘ½ŗāŗó£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø””””£©| A£® | ÉżøßĪĀ¶Č£¬Ę½ŗāÕżŅĘ | |
| B£® | Ź¹ÓĆ“ß»Æ¼Į£¬DµÄ°Ł·Öŗ¬ĮæŌö¼Ó | |
| C£® | m£¼p+q | |
| D£® | BµÄæÅĮ£Ō½Š”£¬·“Ó¦ĖŁĀŹŌ½æģ£¬ÓŠĄūÓŚĘ½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ”÷H1£¾”÷H2£¾”÷H3 | B£® | ”÷H1£¾”÷H3£¾”÷H2 | C£® | ”÷H3£¾”÷H2£¾”÷H1 | D£® | ”÷H2£¾”÷H1£¾”÷H3 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com