
| A. | CCl4的电子式: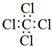 | B. | 乙烯的球棍模型 | ||
| C. | 乙酸的最简式:CH2O | D. | 丙烯醛的结构简式:CH2CHCHO |
分析 A.氯原子未成键的孤对电子对未标出;
B. 为比例模型,不是球棍模型;
为比例模型,不是球棍模型;
C.根据乙酸的分子式确定其最简式;
D.丙烯醛分子中含有醛基和碳碳双键,漏掉了碳碳双键.
解答 解:A.氯原子未成键的孤对电子对未标出,四氯化碳电子式为 ,故A错误;
,故A错误;
B. 是乙烯的比例模型,乙烯的球棍模型为:
是乙烯的比例模型,乙烯的球棍模型为: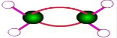 ,故B错误;
,故B错误;
C.乙酸的分子式为C2H4O2,则其最简式:CH2O,故C正确;
D.丙烯醛分子中含有碳碳双键和醛基,其正确的结构简式为:CH2=CHCHO,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及球棍模型与比例模型、电子式、结构简式、最简式等知识,明确常见化学用语的概念及书写原则为解答关键.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热,平衡向正向移动,Kw不变 | |
| B. | 向水中加入少量NaOH固体,水电离的c(OH-)增大 | |
| C. | 向水中加入少量CH3COONa固体,平衡向正向移动,Kw增大 | |
| D. | 向水中加入少量NaHSO4固体,水的电离平衡向逆向移动,c(H+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 编号 | HA的物质的量 浓度(mol•L-1) | NaOH的物质的量 浓度(mol•L-1) | 混合后溶 液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 异胡薄荷醇的分子式为C10H17O | |
| B. | 异胡薄荷醇在NaOH醇溶液中可发生消去反应 | |
| C. | 青蒿素分子中含有7个手性碳原子 | |
| D. | 青蒿素在热的酸、碱溶液中均可稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10 mL量筒量取7.13mL稀盐酸 | |
| B. | 用托盘天平称量25.20g NaCl | |
| C. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| D. | 用25 mL滴定管做中和滴定时,用去某浓度的碱溶液21.70 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与足量的铁反应转移的电子数是2NA | |
| B. | 常温常压下22.4L HCl气体含有的分子数是NA | |
| C. | 0.1mol/L CuCl2溶液中Cl-数目是0.2NA | |
| D. | 32gO2中含有的原子数是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O用作呼吸面具的供氧剂 | |
| B. | 氧化铝常用于制造耐火材料 | |
| C. | 米汤可检验碘盐中的碘酸钾 | |
| D. | 食品包装袋内放入生石灰可以防止食品因氧化而变质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com