
【题目】已知可逆反应X(g)+Y(g)2Z(g),在容积为2L 的密闭容器中反应,有关物质的物质的量的变化如图所示.下列叙述正确的是( ) 
A.a为1.60
B.X和Y的转化率相等
C.0~10min的平均速率V(Z)=0.079molL﹣1min﹣1
D.容器内Z的浓度最大可以达到1.00 mol/L
【答案】C
【解析】解:图像分析可知XY为反应物,Z为生成物,XY的起始量为1.20mol,1.00mol,达到平衡状态X为0.41mol,Y为0.21mol,反应消耗X物质的量=1.20mol﹣0.41mol=0.79mol,消耗Y物质的量=1.00mol﹣0.21mol=0.79mol,
X(g)+ | Y(g) | 2Z(g) | ||
起始量(mol) | 1.20 | 1.00 | 0 | |
变化量(mol) | 0.79 | 0.79 | a=0.79×2=1.58 | |
平衡量(mol) | 0.41 | 0.21 | 1.58 |
A.上述计算得到a为1.58,故A错误;
B.X转化率= ![]() ×100%=
×100%= ![]() ×100%=65.8%,Y转化率=
×100%=65.8%,Y转化率= ![]() ×100%=
×100%= ![]() ×100%=79%,转化率不同,故B错误;
×100%=79%,转化率不同,故B错误;
C.Z反应速率v= ![]() =
= ![]() =0.079mol/Lmin,故C正确;
=0.079mol/Lmin,故C正确;
D.反应是可逆反应,XY比较,若Y全部转化生成Z物质的量为2mol,浓度为1mol/L,反应是可逆反应不能进行彻底,容器内Z的浓度最大不能达到1.00 mol/L,故D错误;
故选C.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效),以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】水热法制备纳米颗粒Y的反应是3Fe2++2S2O32﹣+O2+XOH﹣═Y+S4O62﹣+2H2O,下列说法中,正确的是( )
A.Y的化学式为Fe2O3
B.x=6
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为 ![]() mol
mol
D.每生成1mol Y,反应转移的电子总数为4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所使用的装置(夹持装置略)、试剂和操作方法都正确的是( )
A.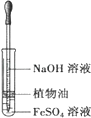 观察Fe(OH)2的生成
观察Fe(OH)2的生成
B.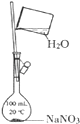 配制一定物质的量浓度的NaNO3溶液
配制一定物质的量浓度的NaNO3溶液
C.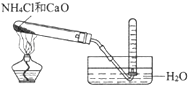 实验室制取氨
实验室制取氨
D.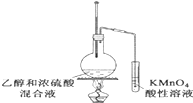 验证乙烯的生成
验证乙烯的生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.化学反应中的能量变化都表现为热量变化
B.需要加热才能发生的反应不一定是吸热反应
C.向醋酸钠溶液中滴入酚酞试液,加热后若溶液红色加深,则说明盐类水解是吸热的
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列反应所画图象错误的是( )
A | B | C | D |
将二氧化硫通入 | 将氨水滴入到一定 | 将铜粉加入到 | 将铁粉加入到一 |
|
|
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定.生产K2FeO4的工艺流程如图所示: 
(1)写出“氧化”过程中生成Na2FeO4的化学方程式: .
(2)“转化”过程中发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列事实所得出的相应结论正确的是( )
实验事实 | 结论 | |
A | Cl2的水溶液可以导电 | Cl2是电解质 |
B | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
C | 将Na2CO3溶液与苯酚悬浊液混合溶液变澄清 | 酸性:苯酚>HCO3- |
D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--选修2:化学与技术]双氧水是一种重要的氧化剂、漂白剂和消毒剂.生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水.回答下列问题:
(1)蒽醌法制备H2O2理论上消耗的原料是 , 循环使用的原料是 , 配制工作液时采用有机溶剂而不采用水的原因是 .
(2)氢化物A中反应的化学方程式为 . 进入氧化塔C的反应混合液中的主要溶质为 .
(3)萃取塔D中的萃取剂是 , 选择其作萃取剂的原因是 .
(4)工作液再生装置F中要除净残留的H2O2 , 原因是 .
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为 , 一种双氧水的质量分数为27.5%(密度为1.10gcm﹣3),其浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W,X,Y,Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01molL﹣1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( ) 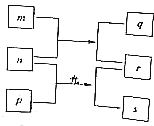
A.原子半径的大小W<X<Y
B.元素的非金属性Z>X>Y
C.Y的氢化物常温常压下为液态
D.X的最高价氧化物的水化物为强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com