
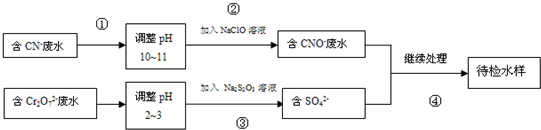
分析 (1)由转化图及图中的物质可知,NaClO、Cr2O72-离子都具有氧化性,则实现离子的转化是利用氧化还原反应实现的;
(2)利用盐的水解来分析盐溶液显碱性的原因;
(3)CN-离子具有还原性、NaClO具有氧化性,利用氧化还原来分析,并注意无气体生成来判断生成物;
(4)利用每0.4molCr2O72-转移2.4mol的电子来计算被还原后Cr元素的化合价,再书写离子方程式;
(5)根据铜离子与氢氧根离子反应生成沉淀及沉淀的转化来分析;
(6)氨气极易溶于水,二氧化碳在水中的溶解度较小.
解答 解:(1)由图可知,将废水中的离子实现上述转化时,利用了氧化还原反应,则主要使用的方法为氧化还原法,
故答案为:氧化还原法;
(2)NaClO溶液呈碱性,是因次氯酸根离子水解生成氢氧根离子导致的,则离子反应为ClO-+H2O HClO+OH-,
HClO+OH-,
故答案为:ClO-+H2O?HClO+OH-;
(3)碱性条件下,CN-离子与NaClO发生氧化还原反应,无气体放出,则生成CNO-、Cl-离子,离子反应为CN-+ClO-═CNO-+Cl-,
故答案为:CN-+ClO-═CNO-+Cl-;
(4)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O,
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(5)因铜离子与氢氧根离子反应生成氢氧化铜沉淀,CuS比Cu(OH)2更难溶,则加入Na2S溶液能发生沉淀的转化,
故答案为:待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq);
(6)侯氏制碱法:向饱和的氯化钠溶液中通入氨气和二氧化碳,可以得到溶解度较小的碳酸氢钠,加热碳酸氢钠可得到碳酸钠,NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2;由于二氧化碳在水中的溶解度较小,氨气极易溶于水,所以应该先通氨气有利于吸收二氧化碳,否则就不能生成大量HCO3-.
故答案为:NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2;只有先通入足量氨气使溶液呈碱性后才能吸收大量CO2,否则就不能生成大量HCO3-.
点评 本题考查利用氧化还原反应来实现废水的转化,注重了化学与实际生产的联系,学生应学会利用物质的性质、元素的化合价、电子守恒等来解答.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 选项 | 甲 | 乙 |
| A | 物质的粒子数 | 阿伏加德罗常数 |
| B | 标况下气体的体积 | 标况下气体摩尔体积 |
| C | 固体的体积 | 固体的密度 |
| D | 溶液的物质的量浓度 | 溶液的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.31a% | B. | 2.25a% | ||
| C. | (100-3a)% | D. | 条件不够无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
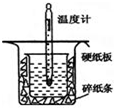 (1)用 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
(1)用 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:| 化学键 | H-H | N-H | N≡N |
| 键能kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在水溶液中或熔融状态下均不导电的化合物叫非电解质 | |
| B. | 电解质、非电解质都指化合物而言,单质不属于此范畴 | |
| C. | NaHSO4电离时生成的阳离子有氢离子,所以是酸 | |
| D. | 纯水的导电性很差,但水不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图两个电解槽中,a、b、c、d均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )
如图两个电解槽中,a、b、c、d均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )| A. | 甲烧杯中a极上最多可析出铜0.64g | |
| B. | 甲烧杯中b极上电极反应式4OH--4e-═2H2O+O2↑ | |
| C. | 乙烧杯中滴入酚酞试液,d极附近先变红 | |
| D. | 烧杯中c极上电极反应式为4H++4e-═2H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com