
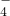 +C2O
+C2O +H+→Mn2++CO2↑+H2O(未配平);
+H+→Mn2++CO2↑+H2O(未配平); +H+→Mn2++CO2↑+H2O(未配平).
+H+→Mn2++CO2↑+H2O(未配平).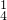 +______C2O
+______C2O +______H+═______Mn2++______CO2↑+______H2O;
+______H+═______Mn2++______CO2↑+______H2O; +______H+═______Mn2++______CO2↑+______H2O.
+______H+═______Mn2++______CO2↑+______H2O. =0.02 mol,
=0.02 mol, ×100%=72.5%.
×100%=72.5%.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
- 4 |
2- 4 |
2- 4 |
1 4 |
2- 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源:2012届湖南省衡阳八中高三第四次月考化学试卷 题型:计算题
(10分)已知高锰酸钾、二氧化锰在酸性条件下能将草酸钠(Na2C2O4)氧化:
MnO4—+C2O42—+H+―→Mn2++CO2↑+H2O(未配平);
MnO2+C2O42—+H+―→Mn2++CO2↑+H2O(未配平)。
为测定某软锰矿中二氧化锰的质量分数,准确称量1.20 g软锰矿样 品,加入2.68 g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到容量瓶中用蒸馏水稀释至刻度,从中取出25.0 mL,用0.0200 mol·L-1高锰酸钾溶液进行滴定。当加入20.0 mL溶液时恰好完全反应,试根据以上信息完成下列各题:
品,加入2.68 g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到容量瓶中用蒸馏水稀释至刻度,从中取出25.0 mL,用0.0200 mol·L-1高锰酸钾溶液进行滴定。当加入20.0 mL溶液时恰好完全反应,试根据以上信息完成下列各题:
(1)配平上述两个离子方程式:
___MnO+___C2O+___H+===___Mn2++___CO2↑+___H2O;
___MnO2+__C2O+___H+===___Mn 2++___CO2↑+__H2O。
2++___CO2↑+__H2O。
(2)欲求得软锰矿中二氧化锰的质量分数,还缺一个数据,这个数据是__________(填数据所代表的意义)。
(3)若该数据的数值为250,求该软锰矿中二氧化锰的质量分数(写出计算过程)。(4分)
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| -4 |
| 2-4 |
| 2-4 |
| 14 |
| 2-4 |
| 2-4 |
查看答案和解析>>
科目:高中化学 来源:0118 月考题 题型:计算题
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山西省大同一中高三(上)化学诊断试卷(四)(解析版) 题型:解答题
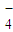 +C2O
+C2O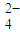 +H+→Mn2++CO2↑+H2O(未配平);
+H+→Mn2++CO2↑+H2O(未配平);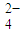 +H+→Mn2++CO2↑+H2O(未配平).
+H+→Mn2++CO2↑+H2O(未配平).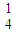 +______C2O
+______C2O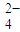 +______H+═______Mn2++______CO2↑+______H2O;
+______H+═______Mn2++______CO2↑+______H2O;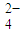 +______H+═______Mn2++______CO2↑+______H2O.
+______H+═______Mn2++______CO2↑+______H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com