
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | C3H8 和 C3H6 | B. | C2H6 和 C3H6 | C. | C2H4 和 C4H8 | D. | CH4 和 C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
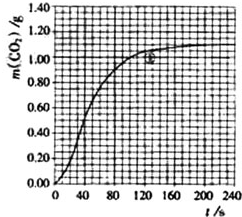 某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探 究大理石规格(粗、细)对该反 应速率的影响;) |
| ② | ||||
| ③ | ||||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | BaCl2、H2SO4、MgCl2 | B. | CaCl2、HNO3、BaCl2 | ||
| C. | CaCl2、HNO3、NaCl | D. | BaCl2、HCl、Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 长期大量服用阿司匹林可预防疾病,没有毒副作用 | |
| B. | 碘酒能使蛋白质变性,常用于外敷消毒 | |
| C. | 使用青霉素可直接静脉注射,不需进行皮肤敏感试验 | |
| D. | 随着平价药房的开设,生病了都可以到药店自己买药服用 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ⅠA元素的电负性从上到下逐渐减小,而ⅦA元素的电负性从上到下逐渐增大 | |
| B. | 最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大 | |
| C. | 碳原子由1s22s22p2转化成1s22s12p3,这一过程中释放能量 | |
| D. | NaH的存在能支持可将氢元素放在ⅦA的观点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com