
”¾ĢāÄæ”æ·ĻĘśĪļµÄ×ŪŗĻĄūÓĆ¼ČÓŠĄūÓŚ½ŚŌ¼×ŹŌ“£¬ÓÖÓŠĄūÓŚ±£»¤»·¾³£®ŹµŃéŹŅĄūÓĆ·Ļ¾É»ĘĶ£ØCu”¢ZnŗĻ½š£¬ŗ¬ÉŁĮæŌÓÖŹFe£©ÖʱøµØ·Æ¾§Ģå£ØCuSO45H2O£©¼°ø±²śĪļZnO£®ÖʱøĮ÷³ĢĶ¼ČēĻĀ£ŗ 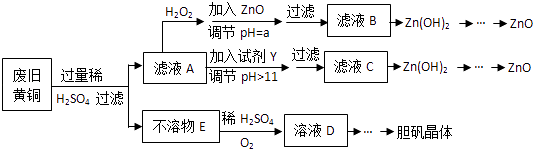
ŅŃÖŖ£ŗZn¼°»ÆŗĻĪļµÄŠŌÖŹÓėAl¼°»ÆŗĻĪļµÄŠŌÖŹĻąĖĘ£¬pH£¾11Ź±Zn£ØOH£©2ÄÜČÜÓŚNaOHČÜŅŗÉś³É[Zn£ØOH£©4]2©ĻĀ±ķĮŠ³öĮĖ¼øÖÖĄė×ÓÉś³ÉĒāŃõ»ÆĪļ³ĮµķµÄpH£ØæŖŹ¼³ĮµķµÄpH°“½šŹōĄė×ÓÅضČĪŖ1.0molL©1¼ĘĖć£©£®
Fe3+ | Fe2+ | Zn2+ | |
æŖŹ¼³ĮµķµÄpH | 1.1 | 5.8 | 5.9 |
³ĮµķĶźČ«µÄpH | 3.0 | 8.8 | 8.9 |
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©¼ÓČėZnOµ÷½ŚpH=aµÄÄæµÄŹĒ £¬ aµÄ·¶Ī§ŹĒ £®
£Ø2£©Óɲ»ČÜĪļEÉś³ÉČÜŅŗDµÄ»Æѧ·½³ĢŹ½ĪŖ £®
£Ø3£©ĀĖŅŗAÖŠ¼ÓČėH2O2·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ £®
£Ø4£©ÓÉČÜŅŗDÖĘµØ·Æ¾§Ģå°üŗ¬µÄÖ÷ŅŖ²Ł×÷²½ÖčŹĒ £®
£Ø5£©ĻĀĮŠŹŌ¼ĮæÉ×÷ĪŖYŹŌ¼ĮµÄŹĒ £® A£®ZnO B£®NaOH C£®Na2CO3D£®ZnSO4
ČōŌŚĀĖŅŗCÖŠÖšµĪ¼ÓČėŃĪĖįÖ±µ½¹żĮ棬Ōņ²śÉśµÄĻÖĻóŹĒ £®
”¾“š°ø”æ
£Ø1£©Ź¹ČÜŅŗÖŠµÄFe3+ĶźČ«³Įµķ£¬Zn2+²»±»³Įµķ£»3.0”Üa£¼5.9
£Ø2£©2Cu+O2+2H2SO4=2CuSO4+2H2O
£Ø3£©2Fe2++H2O2+2H+=2Fe3++2H2O
£Ø4£©Õō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖ
£Ø5£©B£»ĻČ²śÉś°×É«³Įµķŗó³ĮµķČܽā
”¾½āĪö”æ½ā£ŗÓÉĮ÷³ĢæÉÖŖ£¬·Ļ¾É»ĘĶ£ØCu”¢ZnŗĻ½š£¬ŗ¬ÉŁĮæŌÓÖŹFe£©ÖʱøµØ·Æ¾§Ģå£ØCuSO45H2O£©¼°ø±²śĪļZnO£¬·Ļ¾É»ĘĶ¼ÓČė¹żĮæĻ”ĮņĖį¹żĀĖµĆµ½²»ČÜĪļEĪŖCu£¬ĀĖŅŗAĪŖĮņĖįŃĒĢś”¢ĮņĖįŠæ£¬ĀĖŅŗAÖŠ¼ÓČė¹żŃõ»ÆĒāŃõ»Æ¼ĮŃõ»ÆŃĒĢśĄė×ÓĪŖĢśĄė×Ó£¬¼ÓČėŃõ»ÆŠæµ÷½ŚČÜŅŗPH3.0©©5.9ĢśĄė×ÓČ«²æ³Įµķ£¬ŠæĄė×Ó²»³Įµķ£¬¹żĀĖµĆµ½ĀĖŅŗÖŠ¼ÓČė¼īČÜŅŗ³ĮµķŠæĄė×ÓÉś³ÉĒāŃõ»ÆŠæ£¬×ĘÉÕµĆµ½Ńõ»ÆŠæ£»»ņĀĖŅŗAÖŠ¼ÓČė¹żĮæŹŌ¼ĮYĪŖĒāŃõ»ÆÄĘČÜŅŗ£¬ŃĒĢśĄė×ÓČ«²æ³Įµķ£¬¹żĀĖŗóµÄĀĖŅŗÖŠĪŖNa2ZnO2 £¬ ¼ÓČėĖį·“Ӧɜ³ÉĒāŃõ»ÆŠæ³Įµķ£¬×ĘÉÕµĆµ½Ńõ»ÆŠæ£»²»ČÜĪļEÖŠĶØČėŃõĘųĶ¬Ź±¼ÓČėĻ”ĮņĖįČÜŅŗ·“Ӧɜ³ÉĮņĖįĶČÜŅŗ£¬Õō·¢ÅØĖõ£¬ĄäČ“½į¾§µĆµ½ĮņĖįĶ¾§Ģ壻£Ø1£©Ńõ»ÆŠæĪŖ¼īŠŌŃõ»ÆĪļ£¬ÄÜÓėH+·“Ó¦£¬½µµĶH+ÅØ¶Č£¬“ŁŹ¹Fe3+³¹µ×Ė®½āÉś³É Fe£ØOH£©3³Įµķ¶ų³żČ„£¬ĖłŅŌ“š°øŹĒ£ŗ½µµĶH+ÅØ¶Č£¬“ŁŹ¹Fe3+³¹µ×Ė®½āÉś³É Fe£ØOH£©3³Įµķ¶ų³żČ„£¬ĢśĄė×ÓĶźČ«³ĮµķµÄPH=3.0£¬ŠææŖŹ¼³ĮµķµÄPH=5.9£¬ĖłŅŌĀś×ć³Ģ¶ČĢśĄė×Ó£¬ŠæĄė×Ó²»³ĮµķµÄPHȔֵ·¶Ī§ĪŖ£ŗ3.0”Üa£¼5.9£»ĖłŅŌ“š°øŹĒ£ŗŹ¹ČÜŅŗÖŠµÄFe3+ĶźČ«³Įµķ£¬Zn2+²»±»³Įµķ£»3.0”Üa£¼5.9£»£Ø2£©ŅņĪŖŃõĘųŌŚĖįŠŌČÜŅŗÖŠĻČ°ŃĶŃõ»Æ³ÉŃõ»ÆĶ£¬µ±Č»ÕāŹĒŅ»øöĪ¢ČõµÄ·“Ó¦£¬ŠĪ³ÉŅ»øöĘ½ŗā£¬µ«ŹĒŠĪ³ÉµÄŃõ»ÆĶĀķÉĻ¾Ķ»į±»Ļ”ĮņĖįČܽā£¬Ę½ŗā±»“ņĘĘ£¬·“Ó¦³ÆÕż·½Ļņ½ųŠŠ£¬¹Ź¶ųÖš½„Čܽā£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ2Cu+O2+2H2SO4=2CuSO4+2H2O£¬
ĖłŅŌ“š°øŹĒ£ŗ2Cu+O2+2H2SO4=2CuSO4+2H2O£»£Ø3£©ĀĖŅŗAÖŠÖ÷ŅŖŹĒĮņĖįŃĒĢś£¬ĖįŠŌĢõ¼žĻĀ¹żŃõ»ÆĒā¾ßÓŠŃõ»ÆŠŌ£¬ÄÜŃõ»ÆŃĒĢśĄė×ÓÉś³ÉĢśĄė×Ó£¬Ąė×Ó·“Ó¦ĪŖ2Fe2++H2O2+2H+=2Fe3++2H2O£¬
ĖłŅŌ“š°øŹĒ£ŗ2Fe2++H2O2+2H+=2Fe3++2H2O£»£Ø4£©ÓÉČÜŅŗDÖĘµØ·Æ¾§ĢåŹĒ“ÓČÜŅŗÖŠµĆµ½¹ĢĢ壬ŹµŃé²Ł×÷ŠčŅŖÕō·¢ÅØĖõ”¢ĄäČ“½į¾§ŅŌ¼°¹żĀĖµČ²Ł×÷£¬ĖłŅŌ“š°øŹĒ£ŗÕō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖ£»£Ø5£©Zn¼°»ÆŗĻĪļµÄŠŌÖŹÓėAl¼°»ÆŗĻĪļµÄŠŌÖŹĻąĖĘ£¬ĒāŃõ»ÆŠæ¾ßÓŠĮ½ŠŌ£¬pH£¾11Ź±£¬Zn£ØOH£©2ÄÜČÜÓŚNaOHČÜŅŗÉś³É[Zn£ØOH£©4]2© £¬ “Ė¹ż³ĢŠčŅŖµ÷½ŚpHÖµ“óÓŚ11£¬¹ŹæÉŅŌ¼ÓČėĒæ¼īNaOHČÜŅŗ£¬Č»ŗó¼ÓČėĖįĻČÉś³ÉĒāŃõ»ÆŠæ³Įµķ£¬¼ĢŠų¼ÓČėĖį£¬³ĮµķČܽā£¬
ĖłŅŌ“š°øŹĒ£ŗB£»ĻČ²śÉś°×É«³ĮµķŗóČܽā£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚĪļÖŹµÄĮæµÄŠšŹöÖŠ£¬ÕżČ·µÄŹĒ
A.1molČĪŗĪĪļÖŹ¶¼ŗ¬ÓŠ6.02”Į1023øö·Ö×ÓB.0.012gC-12ÖŠŌ¼ŗ¬ÓŠ6.02”Į1023øöĢ¼Ō×Ó
C.1molĖ®ÖŠŗ¬ÓŠ2molĒāŗĶ1molŃõD.1molH2·Ö×ÓÖŠŗ¬ÓŠ2molH
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij³§µÄĖįŠŌ¹¤Ņµ·ĻĖ®ÖŠŗ¬ÓŠŅ»¶ØĮæµÄFe3+”¢Cu2+”¢Au3+µČĄė×Ó£¬ÓŠČĖÉč¼ĘĮĖĶ¼ÖŠµÄ¹¤ŅÕĮ÷³Ģ£¬“Ó·ĻĖ®ÖŠ»ŲŹÕ½š£¬²¢Éś²śŅ»¶ØĮæµÄĢśŗģŗĶŃõ»ÆĶ£ØĶ¼ÖŠ±źŗÅ“¦Ö»ĄūÓĆ¹¤ŅµÉś²śÖŠµÄ³£ÓƵÄĖį”¢¼īŗĶ·ĻĢśŠ¼£©£® 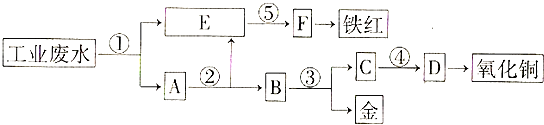
£Ø1£©Ķ¼ÖŠ±źŗÅ“¦Šč¼ÓČėµÄĻąÓ¦ĪļÖŹ·Ö±šŹĒ¢Ł”¢¢Ś”¢¢Ū”¢¢Ü”¢¢Ż£»
£Ø2£©Š“³ö¢Ł“¦ĖłÓŠæÉÄÜ·¢ÉśµÄĄė×Ó·½³ĢŹ½
£Ø3£©Š“³ö¢Ū“¦·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½£»
£Ø4£©ĢśŗģµÄ»ÆѧŹ½ĪŖ£»Š“³öĢśŗģŌŚ¹¤ŅµÉĻµÄŅ»ÖÖÖ÷ŅŖÓĆĶ¾ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ÆѧÓėČĖĄąÉś²ś”¢Éś»īŗĶÉē»įæɳ֊ų·¢Õ¹ĆÜĒŠĻą¹Ų£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
A.ĆŗµÄøÉĮóŹĒĪļĄķ±ä»Æ
B.ĪŖ·ĄÖ¹Ź³Ę·Ńõ»Æ±äÖŹ£¬°ü×°“üÖŠ³£·ÅČėÉśŹÆ»Ņ
C.µķ·ŪÓöµā±äĄ¶£¬æÉÓĆĆ×ĢĄ¼ģŃé¼ÓµāŃĪÖŠŹĒ·ń¼Óµā
D.ĶĘ¹ćŹ¹ÓĆŠĀÄÜŌ“Ęū³µÄܹ»¼õÉŁ²»æÉŌŁÉś×ŹŌ“µÄĻūŗÄ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĀĮ·ÆŹÆ(Ö÷ŅŖ³É·ÖŹĒAl2O3 £¬ »¹ŗ¬ÓŠÉŁĮæŌÓÖŹSiO2”¢Fe2O3)ŹĒ¹¤ŅµÉĻÓĆÓŚĮ¶ĀĮµÄÖ÷ŅŖæóĪļÖ®Ņ»£¬ÓÉĀĮ·ÆŹÆÖĘČ”½šŹōĀĮµÄ¹¤ŅÕĮ÷³ĢĶ¼ČēĻĀ£ŗ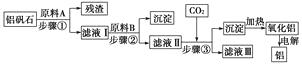
Ēė»Ų“šĻĀĮŠÓŠ¹ŲĪŹĢā£ŗ
£Ø1£©ĻĀĮŠÓŠ¹ŲĀĮ·ÆŹÆŅŌ¼°ÓĆĀĮ·ÆŹÆĮ¶ĀĮµÄĖµ·ØÖŠ£¬²»ÕżČ·µÄŹĒ£Ø £©
A.ĀĮ·ÆŹÆÖŠÖ»ŗ¬ÓŠ½šŹōŃõ»ÆĪļ
B.ĀĮ·ÆŹÆÓėŗÓɳŗ¬ÓŠĻąĶ¬µÄ³É·Ö
C.ĀĮ·ÆŹÆĮ¶ĀĮŠčŅŖĻūŗĵēÄÜ
D.ĀĮ·ÆŹÆĮ¶ĀĮµÄ¹ż³ĢÖŠ²»Éę¼°ÖĆ»»·“Ó¦
£Ø2£©ŌĮĻAµÄĆū³ĘŹĒ £¬ ²½Öč¢ŁÓƵ½µÄÖ÷ŅŖ²£Į§ŅĒĘ÷ÓŠ”£
£Ø3£©ĀĖŅŗ¢ńÖŠŅŖ¼ÓČėÉŌ¹żĮæµÄŌĮĻB£¬ŌĮĻBµÄ»ÆѧŹ½ŹĒ £¬ ²½Öč¢Ś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ”£
£Ø4£©ŌŚ²½Öč¢ŪÖŠ(Ģī”°ÄÜ”±»ņ”°²»ÄÜ”±)ÓĆŃĪĖį“śĢęCO2 £¬ ŌŅņŹĒ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijČÜŅŗÖŠæÉÄÜŗ¬ÓŠH+”¢Na+”¢NH4+”¢Mg2+”¢Fe3+”¢Al3+”¢SO42-”¢CO32-µČĄė×Ó”£µ±ĻņøĆČÜŅŗÖŠ¼ÓČėŅ»¶ØĪļÖŹµÄĮæÅØ¶ČµÄNaOHČÜŅŗŹ±£¬·¢ĻÖÉś³É³ĮµķµÄĪļÖŹµÄĮæĖęNaOHČÜŅŗµÄĢå»ż±ä»ÆµÄĶ¼ĻóČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
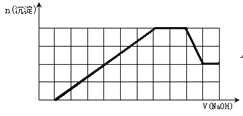
A. ŌČÜŅŗÖŠŗ¬ÓŠµÄŃōĄė×ÓŹĒH+”¢NH4+”¢Mg2+”¢Al3+
B. ŌČÜŅŗÖŠŗ¬ÓŠµÄFe3+ŗĶAl3+µÄĪļÖŹµÄĮæÖ®±ČĪŖ1”Ć1
C. ŌČÜŅŗÖŠŅ»¶Øŗ¬ÓŠSO42-ŗĶNa+
D. ·“Ó¦×īŗóŠĪ³ÉµÄČÜŅŗÖŠŗ¬ÓŠµÄČÜÖŹÖ»ÓŠNa2SO4
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚT”ę Ź±£¬½«a g NH3ĶźČ«ČÜÓŚĖ®£¬µĆµ½V mLČÜŅŗ£¬¼ŁÉčøĆČÜŅŗµÄĆܶČĪŖ¦Ń gcm©3 £¬ ČÜÖŹµÄÖŹĮæ·ÖŹżĪŖw£¬ĘäÖŠŗ¬NH3µÄĪļÖŹµÄĮæĪŖb mol£®ĻĀĮŠŠšŹöÖŠÕżČ·µÄŹĒ£Ø £©
A.ČÜÖŹµÄÖŹĮæ·ÖŹżĪŖw= ![]() ”Į100%
”Į100%
B.ČÜÖŹµÄĪļÖŹµÄĮæÅضČc= ![]() ?mol?L©1
?mol?L©1
C.ČÜŅŗÖŠc£ØOH©£©= ![]() ?mol?L©1
?mol?L©1
D.ÉĻŹöČÜŅŗÖŠŌŁ¼ÓČėV mLĖ®ŗó£¬ĖłµĆČÜŅŗČÜÖŹµÄÖŹĮæ·ÖŹż“óÓŚ0.5w
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚ½šŹōŅ±Į¶µÄĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
A.ÓÉÓŚĀĮµÄ»īĘĆŠŌĒ棬¹Ź¹¤ŅµÉĻ²ÉÓƵē½āČŪČŚA1C13µÄ·½·ØÉś²śµ„ÖŹĀĮ
B.½«ÄĘĶ¶ČėĀČ»ÆĆ¾±„ŗĶČÜŅŗÖŠ£¬æÉÖĆ»»³öĆ¾µ„ÖŹ
C.Ņ±Į¶½šŹōµÄ·½·Ø£¬±¾ÖŹÉĻŹĒÓɽšŹōµÄ»īĘĆŠŌ¾ö¶ØµÄ
D.ĀĮČČ·“Ó¦ŠčŅŖŌŚøßĪĀĻĀ½ųŠŠ£¬ŹĒŅ»øöµäŠĶµÄĪüČČ·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČķĆĢæóµÄÖ÷ŅŖ³É·ÖĪŖMnO2 £¬ ŗ¬ÉŁĮæAl2O3ŗĶSiO2”£ÉĮŠææóÖ÷ŅŖ³É·ÖĪŖZnS£¬ŗ¬ÉŁĮæFeS”¢CuS”¢CdSŌÓÖŹ”£ĻÖŅŌČķĆĢæóŗĶÉĮŠææóĪŖŌĮĻÖʱøMnO2ŗĶZn£¬Ęä¼ņ»ÆĮ÷³ĢČēĻĀ£ØÖŠ¼ä²śĪļµÄ¹ĢĢå²æ·ÖŅŃ¾ĀŌČ„£©”£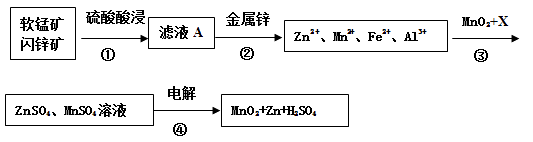
ŅŃÖŖ£ŗ ¢ń£®æóŹÆÖŠĖłÓŠ½šŹōŌŖĖŲŌŚĀĖŅŗAÖŠ¾łŅŌĄė×ÓŠĪŹ½“ęŌŚ”£
¢ņ£®ø÷ÖÖ½šŹōĄė×ÓĶźČ«³ĮµķµÄpHČēĻĀ±ķ£ŗ
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©²½Öč¢ŁÖŠĪŖĮĖ¼ÓæģĮņĖįµÄ½žČ”ĖŁĀŹ£¬æɲÉÓƵķ½·ØŹĒ£ØČĪŠ“Ņ»ÖÖ£©”£¢ŁÖŠ·¢Éś¶ąøö·“Ó¦£¬ĘäÖŠMnO2”¢FeSÓėĮņĖį¹²ČČŹ±ÓŠµ»ĘÉ«ĪļÖŹĪö³ö£¬ČÜŅŗ±äĪŖ×Ų»ĘÉ«£¬Š“³öMnO2”¢FeSÓėĮņĖį¹²ČČ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½”£
£Ø2£©²½Öč¢Ś¼ÓČė½šŹōŠæŹĒĪŖĮĖ»ŲŹÕ½šŹō£¬»ŲŹÕ½šŹōµÄÖ÷ŅŖ³É·ÖŹĒ”£
£Ø3£©²½Öč¢ŪÖŠMnO2µÄ×÷ÓĆŹĒ £¬ĮķĶāŅ»ÖÖĪļÖŹXæÉŅŌŹĒ ”£
A.ZnO B.MgCO3 C. MnCO3 D.Cu(OH)2
£Ø4£©MnO2ÓėLi¹¹³ÉLiMnO2 £¬ ĖüæÉ×÷ĪŖijļ®Ąė×Óµē³ŲµÄÕż¼«²ÄĮĻ£¬µē³Ų·“Ó¦·½³ĢŹ½ĪŖ£ŗ Li1-xMnO2+LixC6=LiMnO2+6C£¬Š“³öøĆļ®Ąė×Óµē³ŲµÄÕż¼«µē¼«·“Ó¦Ź½”£
£Ø5£©ŅŃÖŖ£ŗHCNµÄµēĄė³£ŹżK=4.9”Į10£10 £¬ H2SµÄµēĄė³£ŹżK1=1.3”Į10ØD7 £¬ K2=7.0”Į10ØD15 £¬ ĻņNaCNČÜŅŗÖŠĶØČėÉŁĮæµÄH2SĘųĢ壬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ”£ŌŚ·ĻĖ®“¦ĄķĮģÓņÖŠ³£ÓĆH2S½«Mn2+×Ŗ»ÆĪŖMnS³żČ„£¬Ļņŗ¬ÓŠ0.020 mol”¤L-1Mn2+·ĻĖ®ÖŠĶØČėŅ»¶ØĮæµÄH2SĘųĢ壬µ÷½ŚČÜŅŗµÄpH=a£¬µ±HSØDÅضČĪŖ1.0”Į10ØD4 mol”¤L-1Ź±£¬Mn2+æŖŹ¼³Įµķ£¬Ōņa=”£[ŅŃÖŖ£ŗKsp(MnS)=1.4”Į10ØD15]
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com