
分析 (1)根据反应物中某元素化合价的降低来分析氧化剂,并利用气体的性质来分析气体的吸收;
(2)根据氧化还原反应中生成的H3AsO4的物质的量与转移电子数的关系来计算;NO2与NaOH溶液反应生成硝酸钠和亚硝酸钠;
(3)根据NO2与11.2L O2(混合后用水吸收全部转化成浓HNO3,再利用碳与浓硝酸的反应来分析解答.
解答 解:(1)因As2S3在该反应中As元素的化合价降低,则As2S3为氧化剂,又H2S是还原性气体可用碱液吸收或硫酸铜溶液吸收,
故答案为:As2S3;氢氧化钠(或硫酸铜溶液);
(2)由反应As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O可知,As2S3作还原剂,转移电子数为2×(5-3)+3×(0+2)=10,
则生成2molH3AsO4时反应中转移电子的物质的量为10mol;NO2与NaOH溶液反应生成硝酸钠和亚硝酸钠,其反应的离子方程式为:NO2+2OH-=NO2-+NO3-+H2O;
故答案为:10mol;NO2+2OH-=NO2-+NO3-+H2O;
(3)由NO2与11.2LO2混合后用水吸收全部转化成浓HNO3,则4NO2+O2+2H20═4HNO3,氧气的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,
则由反应可知硝酸的物质的量为0.5mol×4=2mol;
C与浓硝酸反应生成二氧化碳和二氧化氮、水,其反应方程式为:C+4HNO3=CO2↑+4NO2↑+2H2O;
若硝酸完全反应,则根据电子守恒可知生成CO2的量是0.5mol×$\frac{4}{4}$=0.5mol,
但考虑到随着反应到进行,硝酸的浓度会降低而稀硝酸不与碳反应,则产生的CO2的量小于0.5mol,
故答案为:C+4HNO3=CO2↑+4NO2↑+2H2O;a.
点评 本题考查氧化还原反应中的有关计算,明确物质中元素的化合价、电子守恒、物质的性质是解答的关键,并注意化学反应的发生对物质浓度的要求来解答即可.


科目:高中化学 来源: 题型:解答题
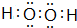 .
.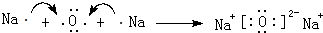 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、H2S、PH3的稳定性依次增强 | |
| B. | Na、Mg、Al、Si的还原性逐渐增强 | |
| C. | O、S、Na、K的原子半径依次增大 | |
| D. | KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16.32.48.64 | B. | 16.17.18.19 | C. | 16.30.44.58 | D. | 16.28.40.52 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍原子的半径大于硼原子的半径 | |
| B. | 相同条件下,单质铍与酸反应比与单质锂与酸反应剧烈 | |
| C. | 氢氧化铍的碱性比氢氧化钙的碱性强 | |
| D. | 单质铍能与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
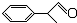 )曾入选伦敦奥运会指定产品,下面是工业合成龙葵醛的路线图(部分反应条件及副产物已略去),回答问题:
)曾入选伦敦奥运会指定产品,下面是工业合成龙葵醛的路线图(部分反应条件及副产物已略去),回答问题: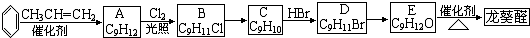
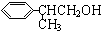 +O2
+O2
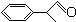 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CHICH2 CH3 | B. | CH3OH | C. | (CH3)3COH | D. | (CH3)3C-CH2C1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 →
→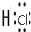 .
. 或
或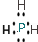 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com