
| Ԫ�� | �����Ϣ |
| X | XԪ�ؿ��γ���Ȼ����Ӳ���������� |
| Y | �䵥��Ϊ˫ԭ�ӷ��ӣ�������⻯���ˮ��Һ��ʹ��̪��� |
| Z | Z�Ƕ�������������ʧȥ���ӵ�Ԫ�� |
| M | M��һ��ͬλ�ص�������Ϊ34��������Ϊ18 |
| N | N�Ǿ����Ϻ�ɫ����Ľ������кܺõ���չ�ԡ������Ժ͵����� |
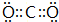 ��
������ X��Y��Z��M��N��Ԫ�����ڱ�ǰ�������еij���Ԫ�أ�ԭ��������������XԪ�ؿ��γ���Ȼ����Ӳ���������ʣ���XΪCԪ�أ�Y����Ϊ˫ԭ�ӷ��ӣ�������⻯���ˮ��Һ��ʹ��̪��죬��YΪNԪ�أ�Z�Ƕ�������������ʧȥ���ӵ�Ԫ�أ���ZΪNa��M��һ��ͬλ�ص�������Ϊ34��������Ϊ18����������Ϊ34-18=16����MΪSԪ�أ�N�Ǿ����Ϻ�ɫ����Ľ������кܺõ���չ�ԡ������Ժ͵����ԣ���NΪCu��
��1������Ԫ��������=���Ӳ�����������=������������ X�����������ΪCO2��
��2��X�����������ΪCO2��Z������������Ӧˮ����ΪNaOH��4.48L CO2Ϊ$\frac{4.48L}{22.4L/mol}$=0.2mol��NaOH���ʵ���Ϊ1L��0.3mol•L-1=0.3mol������1��2��n��CO2����n��NaOH��=2��3��1��1���ʷ�Ӧ����Na2CO3��NaHCO3�����������ӡ�̼ԭ���غ����Na2CO3��NaHCO3���ʵ�����������д���ӷ���ʽ��
��3��������Ӧ��N2H4+O2=N2+2H2O������1mol N2H4��Ӧ�ų���������ע�����ʵľۼ�״̬�뷴Ӧ����д�Ȼ�ѧ����ʽ��
��4��������Ӧ��Cu+HCl+O2�TCuCl+HO2��
A����Ԫ�ػ��ϼ۽��ͣ�����Ϊ��������
B��HO2��һ�����ᣬ����Ӧ��
C����ԭ������HO2��
D������CuԪ�ػ��ϼۼ���ת�Ƶ��ӣ�
��5��N��Na��Ԫ���γɵĻ�����H�����������İ�ȫ���ң�����Hʹ����ȫ�ֽ⣬�������ֵ��ʣ������ɵ������Ƶ��ʣ����㵪�����Ƶ����ʵ���������H��Na��Nԭ����Ŀ֮��ȷ����ѧʽ��
��� �⣺X��Y��Z��M��N��Ԫ�����ڱ�ǰ�������еij���Ԫ�أ�ԭ��������������XԪ�ؿ��γ���Ȼ����Ӳ���������ʣ���XΪCԪ�أ�Y����Ϊ˫ԭ�ӷ��ӣ�������⻯���ˮ��Һ��ʹ��̪��죬��YΪNԪ�أ�Z�Ƕ�������������ʧȥ���ӵ�Ԫ�أ���ZΪNa��M��һ��ͬλ�ص�������Ϊ34��������Ϊ18����������Ϊ34-18=16����MΪSԪ�أ�N�Ǿ����Ϻ�ɫ����Ľ������кܺõ���չ�ԡ������Ժ͵����ԣ���NΪCu��
��1��MΪSԪ�أ���Ԫ�����ڱ��е�λ��Ϊ���������ڢ�A�壬X�����������ΪCO2������ʽΪ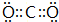 ��
��
�ʴ�Ϊ���������ڢ�A�壻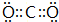 ��
��
��2��X�����������ΪCO2��Z������������Ӧˮ����ΪNaOH��4.48L CO2Ϊ$\frac{4.48L}{22.4L/mol}$=0.2mol��NaOH���ʵ���Ϊ1L��0.3mol•L-1=0.3mol������1��2��n��CO2����n��NaOH��=2��3��1��1���ʷ�Ӧ����Na2CO3��NaHCO3����Na2CO3��NaHCO3���ʵ����ֱ�Ϊxmol��ymol����$\left\{\begin{array}{l}{x+y=0.2}\\{2x+y=0.3}\end{array}\right.$�����x=y=0.1���ʷ�����Ӧ�����ӷ���ʽΪ��3OH-+2CO2=HCO3-+CO32-+H2O��
�ʴ�Ϊ��3OH-+2CO2=HCO3-+CO32-+H2O��
��3��N2H4�ǻ���ij���ȼ�ϣ�16.0g N2H4Һ̬ȼ������������ȫȼ�����ɵ�����Һ̬ˮʱ���ų�312kJ������1mol N2H4��Ӧ�ų�������Ϊ312kJ��$\frac{1mol��32g/mol}{16g}$=642kJ���÷�Ӧ���Ȼ�ѧ����ʽ��N2H4��l��+O2��g��=N2��g��+2H2O��l����H=-624 kJ•mol-1��
�ʴ�Ϊ��N2H4��l��+O2��g��=N2��g��+2H2O��l����H=-624 kJ•mol-1��
��4��������Ӧ��Cu+HCl+O2�TCuCl+HO2��
A��O2����Ԫ�صĻ��ϼ���0�ۣ�HO2����Ԫ�ص�ƽ�����ϼ���-0.5�ۣ�Ԫ�ػ��ϼ۽��ͣ���O2������������A��ȷ��?
B��HO2Ϊ�����ᣬ��һ�����ᣬ����Ӧ����HO2�ڼ��в����ȶ����ڣ���B��ȷ��
C����ԭ������HO2����C����
D��1molCu�μӷ�Ӧ����+1��ͭ���ӣ���1mol���ӷ���ת�ƣ���D��ȷ��
��ѡ��C��
��5��N��Na��Ԫ���γɵĻ�����H�����������İ�ȫ���ң�����Hʹ����ȫ�ֽ⣬�������ֵ��ʣ������ɵ������Ƶ��ʣ��������ʵ���=$\frac{3.36L}{22.4L/mol}$=0.15mol��������=0.15mol��28g/mol=4.2g����NaԪ������=6.5g-4.2g=2.3g�����ʵ���=$\frac{2.3g}{23g/mol}$=0.1mol����H��Na��Nԭ����Ŀ֮��=0.1mol��0.15mol��2=1��3����HΪNaN3���������Ӿ��壬
�ʴ�Ϊ��NaN3�����Ӿ��壮
���� ���⿼��ṹ����λ�ù�ϵӦ�á�����ʽ����ѧ���㡢���ӷ���ʽ���Ȼ�ѧ����ʽ�������ƶϵȣ��Ƕ�ѧ���ۺ�������֪ʶǨ��Ӧ�ÿ��飬�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
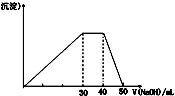 ѧϰ��ѧҪȷ���ջ�ѧ����������о���������Ҫ��ش��������⣺
ѧϰ��ѧҪȷ���ջ�ѧ����������о���������Ҫ��ش��������⣺| | �� | �� | �� | ���������� | ���������� |
| ��һ�� | Na2CO3 | H2SO4 | NaHCO3 | CaO | CO2 |
| �ڶ��� | NaOH | HCl | NaCl | Na2O | SO2 |
| ������ | NaOH | CH3COOH | CaF2 | Al2O3 | SO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״����2.24LO2 | B�� | ��NA����ԭ�ӵ�H2 | ||
| C�� | 44gCO2 | D�� | ��3.01��1023�����ӵ�CH4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A����0.10mol/LNaOH��Һ | B����ȥCO�е�CO2 | C������ȡ��ˮ�е�I2�ֳ�ˮ���IJ��� | D����¼�ζ��յ����Ϊ12.20mL |
 |  |  |  |
| A�� | ����0.10mol/L NaOH��Һ | |
| B�� | ��ȥCO�е�CO2 | |
| C�� | ����ȡ��ˮ�е�I2�ֳ�ˮ���IJ��� | |
| D�� | ��¼�ζ��յ����Ϊ12.20mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �Ҵ���һ����Ҫ�Ļ���ԭ�ϣ����Ҵ�Ϊԭ���������IJ��ֻ�����Ʒ��ͼ��ʾ���ش��������⣺
�Ҵ���һ����Ҫ�Ļ���ԭ�ϣ����Ҵ�Ϊԭ���������IJ��ֻ�����Ʒ��ͼ��ʾ���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���¸�ѹ | B�� | ���¸�ѹ | C�� | ���µ�ѹ | D�� | ���µ�ѹ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com