
| HBr |
| �������� |

 ���������Ϣ��֪BΪ
���������Ϣ��֪BΪ ��ˮ������CΪ
��ˮ������CΪ ��C�к���-COOH��-OH���ɷ���������Ӧ����X��X�Ľṹ�к���һ��������һ����Ԫ����ӦΪ
��C�к���-COOH��-OH���ɷ���������Ӧ����X��X�Ľṹ�к���һ��������һ����Ԫ����ӦΪ ��������ʵĽṹ�������Լ���ĿҪ������⣮
��������ʵĽṹ�������Լ���ĿҪ������⣮ ���������Ϣ��֪BΪ
���������Ϣ��֪BΪ ��ˮ������CΪ
��ˮ������CΪ ��C�к���-COOH��-OH���ɷ���������Ӧ����X��X�Ľṹ�к���һ��������һ����Ԫ����ӦΪ
��C�к���-COOH��-OH���ɷ���������Ӧ����X��X�Ľṹ�к���һ��������һ����Ԫ����ӦΪ ��
�� �ڼ��������µ�ˮ�ⷴӦ����Ӧ�ķ���ʽΪ
�ڼ��������µ�ˮ�ⷴӦ����Ӧ�ķ���ʽΪ ��
�� ��
�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
�� ����Ӧ��ͬ���칹����NaHCO3��Һ��Ӧ������ų��������к���-COOH����FeC13��Һ������ɫ��Ӧ��˵�����з��ǻ��������ϵ�һ�ȴ���ֻ��һ�֣�˵���ṹ�Գƣ����ܵĽṹΪ
����Ӧ��ͬ���칹����NaHCO3��Һ��Ӧ������ų��������к���-COOH����FeC13��Һ������ɫ��Ӧ��˵�����з��ǻ��������ϵ�һ�ȴ���ֻ��һ�֣�˵���ṹ�Գƣ����ܵĽṹΪ ��
�� ��
��


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| n(CH3)OH |
| n(CO) |
| 3 |
| 2 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
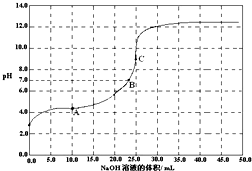 ����ʱ����0.1000mol/L NaOH �ζ� 25.00mL 0.1000mol/LijһԪ��HX���ζ�������pH �仯������ͼ��ʾ������˵����ȷ���ǣ�������
����ʱ����0.1000mol/L NaOH �ζ� 25.00mL 0.1000mol/LijһԪ��HX���ζ�������pH �仯������ͼ��ʾ������˵����ȷ���ǣ�������| A���ζ�ǰ������c��H+�� ���ڼ���c��OH-�� |
| B����A�㣬c��Na+����c��X-����c��HX����c��H+����c��OH-�� |
| C����B�㣬����ǡ����ȫ��Ӧ |
| D����C�㣬c��X-��+c��HX��=0.05 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |

c(HC
| ||
c(C
|
| O | - 3 |
| O | 2- 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ����ͼ��ʾ�������ת����ϵ�У�A��һ�ֹ��嵥�ʣ�E��һ�ְ�ɫ������ˮ�����ʣ��ݴ���գ�
����ͼ��ʾ�������ת����ϵ�У�A��һ�ֹ��嵥�ʣ�E��һ�ְ�ɫ������ˮ�����ʣ��ݴ���գ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��ԭ���Һ��n��N
| ||
B��ԭ���Һ��c��S
| ||
| C��ԭ���Һ��pH=1-lg1.2 | ||
| D���ܽ��Fe������Ϊ2.8g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ѡ�� | ��ѧ��Ӧ | ���ӷ���ʽ | ���� | |||||||||||||||
| A | ̼�������ᷴӦ | C
|
����̼�����������ʣ���Ӧд��������ʽ | |||||||||||||||
| B | ��̼������Һ�еμӹ��������� | C
|
��ȷ | |||||||||||||||
| C | �����ʯ��ˮ�еμ�����KHC
|
HC
|
��������Ca��OH��2����� | |||||||||||||||
| D | ����������Һ����������������Һ��� | 2H++S
|
��ȷ |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������£�pH��ͬ��CH3COOH��Һ��HCN��Һ�ֱ��ˮϡ����ͬ�ı���ʱ��ǰ��pH�仯��С |
| B�������£���Ũ�ȵ�CH3COOH��HCN��ҺpH�����ߴ� |
| C��HCN��Һ��NaOH���������Ϻ�һ���������¹�ϵc��H+��-c��OH-���Tc��CN-��-c��Na+�� |
| D��0.1mol?L-1CH3COOH��HCN��Һ����ˮ�������c��H+����ǰ���Ǻ��ߵ�10m-n�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com