
�������������ʡ�����ȵ���Ҫԭ�ϣ�Χ�ƺϳɰ����ǽ�����һϵ���о�
��1�����������뵪������������������Ӧ�����Ƿ�Ӧ������ȴ����ͬ��
|
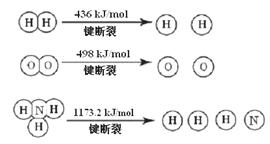
��1�� �������1 mol N��N����Ҫ���� kJ �� ���������л�ѧ�������������еĻ�ѧ���� ���ǿ�����������������������߷�Ӧ��������ͬ��
��2���̵��ǿ�ѧ�������о�����Ҫ���⡣��Ȼ���д�����Ȼ�Ĵ����̵����̣�
N2 (g) + O2 (g) = 2NO (g) ��H = +180.8 kJ/mol ����ҵ�ϳɰ������˹��̵���
�������̵ֹ���Ӧ��ƽ�ⳣ�������н�����ȷ���� ��
| ��Ӧ | �����̵� | ��ҵ�̵� | ||||
| �¶�/�� | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84��10-31 | 0.1 | 5��108 | 1.847 | 0.507 | 0.152 |
A�������£������̵����������ܽ��У�����ҵ�̵��dz�������
B��������ģģ������̵����������
C����ҵ�̵��¶�Խ�ͣ�������������ӦԽ��ȫ
D��KԽ��˵���ϳɰ���Ӧ������Խ��
��3���ں��º����ܱ������а��ռס������ַ�ʽ�ֱ�Ͷ�ϣ����ʵ������±�����ʾ��������Ӧ��3H2 (g) + N2 (g)  2NH3 (g)��ü�������H2��ת����Ϊ40%��
2NH3 (g)��ü�������H2��ת����Ϊ40%��
| N2 | H2 | NH3 | |
| �� | 1 | 3 | 0 |
| �� | 0.5 | 1.5 | 1 |
 ��3H2 (g) + N2 (g)
��3H2 (g) + N2 (g)  2NH3 (g)��ƽ�ⳣ������ʽ
2NH3 (g)��ƽ�ⳣ������ʽ
���ж��������з�Ӧ���еķ��� �������������
��4�������Ǻϳ������ԭ�ϣ�д��������������Ӧ����һ����������̬ˮ���Ȼ�ѧ����ʽ ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
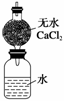
ijУѧ������С��Ϊ�ⶨNaԪ�ص����ԭ����������Ƶ�װ����ͼ����װ��(����ˮ�����)��������Ϊa g����ʵ����ȡ��b g(������)���Ʒ���ˮ�У�����ƿ������ȫ��Ӧ���ٳ�����װ�õ�������Ϊc g���Իش�
(1)ʵ����ȡ��һС���ƣ���Ҫ�õ�_________________________________________��
(2)�˸���ܵ�������___________________________________________________��
�����ƿ��м����������������������ԭ���������ʵ�����ԭ������__________(�ƫ����ƫС�����䡱����ͬ)��
(3)�м�ͬѧ������ͼ�и����������һͬ������ܣ���Ŀ����_____________�������Ƶ����ԭ�������ı���ʽΪ__________��
(4)����ͬѧΪ���������ж�����Ѹ�ٲ���ƫ��ֽ����ڼ���ƿ���ټ���һ����ú�ͣ���Ŀ����___________________________________________________________________
________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��ɫ��Һ��ֻ��������8�������е�ij���֣�Mg2����H����Ag����Na����Cl����HCO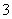 ��OH����NO
��OH����NO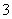 ����֪����Һ��������Ӧ�ų��������Իش��������⣺
����֪����Һ��������Ӧ�ų��������Իش��������⣺
(1)����Ӧ������Al3��������Һ�п��ܴ��ڵ�������__________________��һ�����ڵ���
����________________��һ�������ڵ�������____________����Ӧ�����ӷ���ʽΪ
________________________________________________________________________
________________________________________________________________________��
(2)����Ӧ������[Al(OH)4]��������Һ�п��ܴ��ڵ�������____________��һ�����ڵ�������____________��һ�������ڵ�������____________����Ӧ�����ӷ���ʽΪ__
________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˳����ȷ����
A�����ȶ��ԣ�HF > HCl > HBr > HI
B�����İ뾶��Cl��> Na+ > Mg2+ > Al3+
C������̶ȣ�ͬ�¶�ͬŨ����Һ�У���HCl > CH3COOH > NaHCO3
D����ɢ�����ӵ�ֱ����Fe(OH)3����Һ > Fe(OH)3���� > FeCl3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��H2(g) �� F2(g) = 2HF(g) ��H��? 270 kJ/mol������˵����ȷ����
A������ͬ�����£�1 mol H2��1 mol F2�������ܺʹ���2 mol HF���������
B��1 mol H2��1 mol F2��Ӧ����2 molҺ̬HF�ų�������С��270 kJ
C���÷�Ӧ���淴Ӧ�Ƿ��ȷ�Ӧ
D���÷�Ӧ���̵������仯������ͼ����ʾ
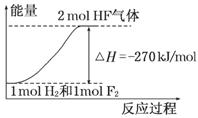
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����һ�����ʵ���Ũ�ȵ�NaOH��Һʱ�����������ҺŨ��ƫ�ߵ�ԭ���ǣ� ����
A������ʱNaOH�Ѿ�����
B��������ƿ��ת����Һʱ������ƿ����������ˮϴ�ӹ�
C������ʱ��������ƿ�ı���
D��ҡ�Ⱥ���Һ����ڱ��ߣ��μ�����ˮ��������ҡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵���У���ȷ���ǣ��� ��
����A��1 Lˮ���ܽ���40 g NaOH��������ҺŨ��Ϊ1 mol/L
����B����1 L 2 mol/L��NaCl��Һ��ȡ��0.5 L������Һ��Ũ��Ϊ1 mol/L
����C������״���µ�HCl����2.24 Lͨ��ˮ���Ƴ�100 mL��Һ��������Һ�����ʵ���Ũ��Ϊ1 mol/L
����D������1 L 0.2 mol/L��CuSO4��Һ������25 g����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ij��Һ�з�̪�ʷۺ�ɫ�����������ڸ���Һ�в��ܴ������ڵ���
A. K+ B. Na+ C. Ba2+ D. Al3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ؽ��������ж��ԡ�ʵ�����мס������ַ�Һ������һ�����ԡ���Һ������ʼ��ԣ���Ҫ�ж�����ΪBa2+���罫�ס�������Һ��һ��������ϣ��������Խ��͡��ҷ�Һ�п��ܺ��е�������
A. Cu2+��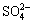 B. Cu2+��Cl- C. K+��
B. Cu2+��Cl- C. K+��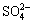 D. Ag+��
D. Ag+��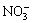
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com