

分析 (1)根据氢键分析解答;
(2)根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;
(3)根据价层电子对互斥理论来确定其杂化方式,价层电子对个数=σ键个数+孤电子对个数;等电子体是具有相同的价电子数和相同原子数的微粒;
(4)根据碘晶胞的结构图可知,在每个晶胞中含有碘分子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,顶点上相邻的两个碘分子的核间距为a cm,则晶胞的体积为a3cm3,根据$ρ=\frac{\frac{4{M}_{r}}{{N}_{A}}}{V}$可计算得相对分子质量;
解答 解:(1)HF分子之间存在氢键,使氢氟酸分子缔合,故答案为:氢键;
(2)H5IO6(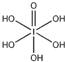 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO3为一元酸,含有1个羟基氢,含非羟基氧原子2个,所以酸性:HIO3>H5IO6,故答案为:>;
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO3为一元酸,含有1个羟基氢,含非羟基氧原子2个,所以酸性:HIO3>H5IO6,故答案为:>;
(3)ClO2-中心氯原子的价层电子对数n=2+$\frac{7+1-2×2}{2}$=4,属于sp3杂化;等电子体具有相同的电子数目和原子数目的微粒,所以与ClO2-互为等电子体的分子为Cl2O、OF2等,故答案为:sp3;Cl2O或OF2;
(4)根据碘晶胞的结构图可知,在每个晶胞中含有碘分子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,顶点上相邻的两个碘分子的核间距为a cm,则晶胞的体积为a3cm3,根据$ρ=\frac{\frac{4{M}_{r}}{{N}_{A}}}{V}$可计算得相对分子质量Mr=$\frac{{a}^{3}ρ{N}_{A}}{4}$,
故答案为:$\frac{{a}^{3}ρ{N}_{A}}{4}$;
点评 本题考查物质结构与性质,比较综合,涉及氢键、杂化轨道、元素周期律、等电子体、晶胞计算等,侧重对主干知识的考查,需要学生熟练掌握基础知识,难度中等.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:解答题
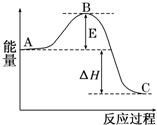 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1molSO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1molSO3(g)的△H=-99kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K3C60中既有离子键,又有共价键 | |
| B. | 1molK3C60中含有的离子数目为63×6.02×1023 | |
| C. | 通常条件下该晶体有良好的导电性 | |
| D. | 该物质的化学式可写为KC20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A与B只能形成一种化合物 | |
| B. | B的离子半径小于C的离子半径 | |
| C. | D元素最高价氧化物的水化物显两性 | |
| D. | 由A、B、C形成的化合物既含离子键又含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子,与水反应产物不完全相同 | |
| B. | 元素T、Q、W、Y的原子半径大小为:T<Q<Y<W | |
| C. | Q与Y组成的常见物质是一种两性物质,结构中含有离子键 | |
| D. | 由Y和T组成的物质YT是,在电子和陶瓷工业上有广泛应用,可以直接由单质Y和T在低温下合成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其水溶液显强酸性,俗称石炭酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 碳酸氢钠溶液中滴入苯酚的水溶液后不会放出二氧化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com