
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
 (1)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(1)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是查看答案和解析>>
科目:高中化学 来源: 题型:
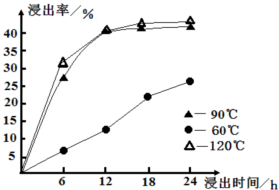
 (2013?深圳一模)水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084% CaO.从中提取钴的主要工艺流程如下:
(2013?深圳一模)水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084% CaO.从中提取钴的主要工艺流程如下: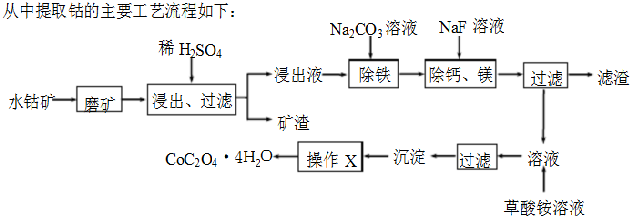
| c(Ca2+) |
| c(Mg2+) |
| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 活性炭 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省泉州市高三质检理综化学试卷(解析版) 题型:填空题
工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺。
I.火法熔炼工艺:将处理过的黄铜矿加人石英,再通人空气进行焙烧,即可制得粗铜。
(1)焙烧的总反应式可表示为:2CuFeS2 + 2SiO2+5O2=2Cu+2FeSi03+4SO2该反应的氧化剂是_____。
(2)下列处理SO2的方法,不合理的是_____
A.高空排放
B.用纯碱溶液吸收制备亚硫酸钠
C.用氨水吸收后,再经氧化制备硫酸铵
D.用BaCl2溶液吸收制备BaSO3
(3)炉渣主要成分有FeO 、Fe2O3 、SiO2 ,Al2O3等,为得到Fe2O3加盐酸溶解后,后续处理过程中,未涉及到的操作有_____。
A过滤;B加过量NaOH溶液;C蒸发结晶;D灼烧;E加氧化剂
II.FeCl3溶液浸取工艺:其生产流程如下图所示
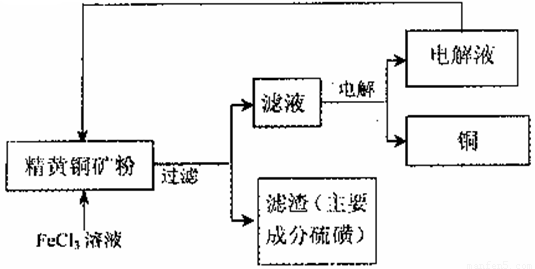
(4)浸出过程中,CuFeS2与FeCl3溶液反应的离子方程式为? _____________。
(5)该工艺流程中,可以循环利用的物质是_____(填化学式)。
(6)若用石墨电极电解滤液,写出阳极的电极反式_____________。
(7)黄铜矿中含少量Pb,调节C1一浓度可控制滤液中Pb2+的浓度,当c(C1一)=2mo1·L-1时溶液中Pb2+物质的量浓度为__mol·L-1。[已知KSP(PbCl2)=1 x 10一5]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com