
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ.且1 mol 氧气分子中的化学键完全断裂时吸收热量496 kJ,水蒸气中1 mol H―O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A. 920 kJ B. 557 kJ C. 436 kJ D. 188 Kj
科目:高中化学 来源: 题型:
【化学一选修5.有机化学基础】(15分)
药物卡托普利的合成原料F、工程材料聚碳酸酯(简称PC)
的合成路线如图所示:
已知:①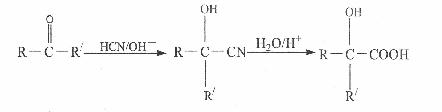
②酯与含羟基的化合物可发生如下酯交换反应:
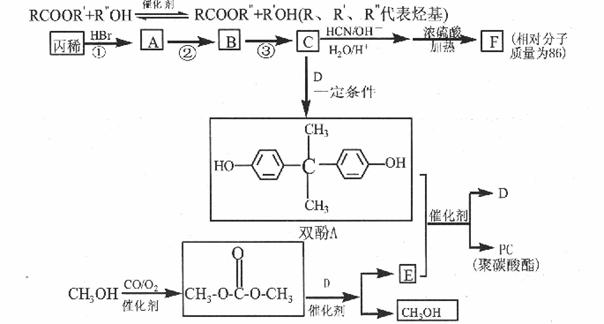
请回答:
(1)C由丙烯经反应①~③合成,C的核磁共振氢谱只有一种峰。
a.①的反应类型是 。
b.②的反应试剂和条件是 。
c.③的化学方程式是 。
(2)9.4g的D与饱和溴水完全反应生成33.lg白色沉淀,D的结构简式是 。
(3)C与D反应生成双酚A的化学方程式 。
(4)F有多种同分异构体,满足下列条件的所有同分异构体的结构简式是 。
①含有甲基 ②含有碳碳双键 ③能发生银镜反应 ④属于酯
(5)PC的结构简式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确是 ( )
A、常温常压下,1 mol甲基(—CH3)所含的电子数为10NA
B、标准状况下,22.4 L水中含分子数为NA
C、在标准状况下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA
D、用惰性电极电解饱和NaCl溶液时,若阴极生成0.2gH2,则电路通过电子0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应热的说法中正确的是
A、一个化学反应是否能在常温下发生与该反应的△H值的大小没有必然联系
B、中和热△H= - 57.3kJ·mol-1,所以1.00L 1.00mol·L-1H2SO4与稀的NaOH溶液恰好完全反应放出57.3kJ的热量
C、用等体积的0.50mol·L-1盐酸、0.55mol·L-1NaOH溶液进行中和热测定的实验,会使测得的值偏大
D、在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状态下的密度为0.76g •L-1 ;W的质子数是X、Y、Z、M四种元素质子数之和的1/2 。下列说法正确的是
A.原子半径:W>Z>Y>X>M B.XZ2 、X2M2 、W2Z2均为共价化合物
C.由X元素形成的单质不一定是原子晶体
D.由Y、Z、M三种元素形成的化合物一定只有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组要完成中和热的测定。(已知t1 为NaOH和HCl起始温度平均值,t2 为终止温度。弱电解质电离是吸热的)
| 实 验 用 品 | 溶 液 温 度 | 中和热 △H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol·L-1NaOH | 50mL.0.5mol·L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol·L-1NaOH | 50mL.0.5mol·L-1HCl | 20℃ | 23.5℃ |
(1)实验桌上备有烧杯(大.小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、温度计、
0.5mol· L-1 盐酸、0.55mol· L-1NaOH溶液,实验尚缺少的玻璃用品是 、 。
(2)他们记录的实验数据在表格中。 已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各溶液的密度均为1g·cm-3。请根据实验结果(计算中和热结果保留一位小数)写出NaOH溶液与HCl溶液反应的热化学方程式:
(3)该小组所测得中和热与57.3kJ·mol-1有偏差,产生偏差的原因可能是( )
A、实验装置保温隔热效果差
B、量取NaOH溶液的体积时俯视读数
C、NaOH溶液分几次倒入盐酸中
D、用温度计测定NaOH溶液起始温度后,将温度计洗净擦干再测定盐酸溶液的温度
(4) 实验中若用50mL0.5mol· L-1 醋酸代替HCl溶液(其他操作不变),则测得的中和热会有偏差,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A~G是前四周期除稀有气体之外原子序数依次增大的七种元素。A与其它元素既不同周期又不同族;B、C的价电子层中未成对电子数都是2;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。请结合题目回答以下问题:
(1)元素名称:B ,G 。
(2)F的价电子排布图 。
(3)写出化合物BC的结构式 。
(4)离子[F(CA)4]— 是F在水溶液中的一种存在形式,其中F的杂化类型是 。
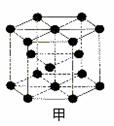 |
(6)B、C之间的元素K可以与A形成KA3,G的离子与KA3可形成[G(KA3)4]2+离子,1mol[G(KA3)4]2+离子中含有的σ键的物质的量为 mol。
(7)在测定A、D形成的分子的相对分子质量时,实验测定值一般高于理论值的主要原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
从经济效益和环境保护考虑,大量制取硝酸铜最宜采用的方法是 ( )
|

|
 C.Cu + HNO3(浓) →Cu(NO3)2 D.Cu CuO Cu(NO3)2
C.Cu + HNO3(浓) →Cu(NO3)2 D.Cu CuO Cu(NO3)2 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com