
分析 (1)金属性最强的元素在周期表的左下角位置,对应的最高价氧化物对应水化物的碱性最强;
(2)元素的非金属性越强,对应的最高价氧化物对应的水化物酸性越强;
(3)同周期元素的原子,从左到右得电子能力逐渐增强,氢化物越来越稳定,同主族元素的原子,从上到下得电子能力逐渐减弱,氢化物越来越不稳定;
(4)非金属性越强氢化物稳定性越强,唯一的氢化物水溶液显碱性的NH3.
解答 解:(1)金属性最强的元素在周期表的左下角位置,元素周期表1~18号元素中Na的金属性最强,其最高价氧化物对应水化物是NaOH,碱性最强,
故答案为:NaOH;
(2)Cl的非金属性仅次于O、F,但O、F无正价,最高价氧化物对应的水化物HClO4酸性最强,故答案为:HClO4;
(3)同周期元素的原子,从左到右得电子能力逐渐增强,氢化物越来越稳定,所以稳定性氨气>甲烷,同主族元素的原子,从上到下得电子能力逐渐减弱,氢化物越来越不稳定,所以稳定性硅烷<甲烷,所以氨气的稳定性强于硅烷,故答案为:SiH4;NH3;
(4)非金属性越强氢化物稳定性越强,F的非金属性最强,其氢化物稳定性最强,唯一的氢化物水溶液显碱性的是NH3,故答案为:HF;NH3.
点评 本题考查元素周期表的结构及应用,侧重元素在周期表的位置及元素周期律的考查,把握原子半径的比较规律及非金属性的比较方法为解答的关键,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯中的甲苯(溴水) | B. | 乙烷中的乙烯(氢气) | ||
| C. | 溴苯中的溴(碘化钾溶液) | D. | 乙醇中的水(新制的CaO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)( mol•L-1) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)( mol•L-1) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | c | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铯碱性强于氢氧化钠 | |
| B. | 碱金属单质从Li到Cs,熔点依次升高 | |
| C. | 碱金属单质均为银白色,从Li到Cs,密度逐渐增大 | |
| D. | 碱金属元素形成的阳离子,从Li+到Cs+,氧化性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

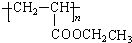 .
. .
. 与
与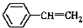 也可以发生类似反应①的反应,其有机产物的结构简式为:
也可以发生类似反应①的反应,其有机产物的结构简式为: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、丙醇 | B. | 乙醇、乙二醇 | C. | 1-丙醇、2-丙醇 | D. | 乙烯、乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3和CH3CH(CH3)2 | B. | CH2=C(CH3)2和CH3CH=CHCH3 | ||
| C. | CH3COOH和HCOOCH3 | D. | CH3CH2CHO和CH3COCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3分子是非极性分子 | |
| B. | 分子内3个N-H键的键长相等,键角相等 | |
| C. | NH3分子内3个N-H键的键长相等,3个键角都等于107°18′ | |
| D. | NH3分子内3个N-H键的键长相等,3个键角都等于120° |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com