
| A. | 该反应的化学方程式为CO+H2O$\frac{\underline{\;催化剂\;}}{高温}$CO2+H2 | |
| B. | 该反应的焓变为正值 | |
| C. | 恒温恒容下,充入氮气,平衡右移 | |
| D. | 升高温度,逆反应速率减小 |
分析 化学平衡常数,是指在一定温度下,可逆反应达到平衡时,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,某反应达到平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$可知该可逆反应为CO2(g)+H2(g)?CO(g)+H2O(g),恒容时,温度升高,H2的浓度减小,说明平衡向正反应移动,该反应正反应为吸热反应.
A、反应达到平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,可知该可逆反应为CO2(g)+H2(g)?CO(g)+H2O(g);
B、恒容时,温度升高,H2的浓度减小,说明平衡向正反应移动,升高温度平衡向吸热反应移动;
C、该反应前后气体的体积不发生变化,恒温恒容时,加入不反应的气体,增大压强,平衡不移动;
D、升高温度,反应物、生成物的活化分子增多,正、逆反应速率都增大.
解答 解:A、平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,可知该可逆反应为CO2(g)+H2(g)?CO(g)+H2O(g),故A错误;
B、恒容时,温度升高,H2的浓度减小,说明平衡向正反应移动,该反应正反应为吸热反应,即反应的焓变为正值,故B正确;
C、恒温恒容时,充入氮气,虽然压强增大,但反应物和生成物的浓度不变,所以平衡不移动,故C错误;
D、升高温度,反应物、生成物的活化分子增多,正、逆反应速率都增大,故D错误.
故选B.
点评 本题考查外界条件对化学平衡的影响、化学平衡常数等,难度中等,注意对化学平衡常数的理解,同一反应,化学计量数不同,平衡常数不同.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 22.4LN2中σ键与π键个数比为1:2 | |
| B. | 反应物和生成物中只有氮气属于非电解质 | |
| C. | 该反应每转移1mol电子,有0.2molKNO3被氧化 | |
| D. | NaN3是只含离子键的离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸的反应OH-+H+=H2O | |
| B. | 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H<0 | |
| B. | 使用催化剂,降低反应的活化能,增大单位体积内活化分子百分数,反应速率增大 | |
| C. | SO2(g)+2CO(g)?2CO2(g)+S(l)达到平衡,保持其他条件不变,分离出硫,正反应速率加快,SO2的转化率提高 | |
| D. | 恒温恒压下,向一平衡体系中通入惰性气体,反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料 | |
| B. | 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 | |
| C. | 在农村推广使用沼气 | |
| D. | 减少资源消耗、增加资源的重复使用和资源的循环再生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
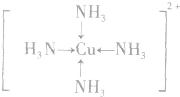 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com