
| A. | 920kJ | B. | 496kJ | C. | 436kJ | D. | 188kJ |
分析 根据化学反应焓变=旧键断裂吸收的能量-新键生成释放的能量,结合反应方程式进行计算;
解答 解:已知1mol氢气完全燃烧生成水蒸气时放出热量242kJ,H2(g)+$\frac{1}{2}$O2(g)=H2O(g),△H=-242KJ/mol,氢气中1mol H-H键完全断裂时吸收热量436kJ,水蒸气中1mol H-O键形成时放出热量463kJ,△H=-242KJ/mol=436kJ/mol+$\frac{1}{2}$×O=O键能-2×463kJ/mol
则氧气中1mol O=O键断裂时吸收热量=496KJ/mol,
故选B.
点评 本题考查反应热的相关计算,题目难度不大,计算的方法是解题的关键,掌握基础是解题关键.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑧ | B. | ④⑤⑦ | C. | ④⑤ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的非金属性次序为c>b | |
| B. | c和d形成的化合物存在离子键 | |
| C. | 最高价氧化物对应水化物的酸性:c>b | |
| D. | 离子半径:d+>c- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的比例模型: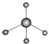 | B. | 甲基的电子式: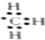 | ||
| C. | 乙烷的分子式:CH3CH3 | D. | 丙烷的结构式:CH3CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
| 无催化剂不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂加热 | 360 | 480 | t | 720 |
| MnO2催化剂加热 | 10 | 25 | 60 | 120 |
| 催化剂MnO2 | 操作情况 | 观察结果 | 反应完成所需时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z是中学化学中常见的三种单质,Y、Z为气体,点燃化合成乙,X的一种离子遇苯酚溶液呈紫色( )
X、Y、Z是中学化学中常见的三种单质,Y、Z为气体,点燃化合成乙,X的一种离子遇苯酚溶液呈紫色( )| A. | Y是Cl2、Z是H2 | |
| B. | 甲为Fe3O4 | |
| C. | X2+能使苯酚呈紫色 | |
| D. | 甲与Z高温下反应的化学方程式为3H2+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com